-
- 블루프린트 GIST 치료제 ‘아이바키트’ 진행성 전신성비만세포증 적응증 승인
- 미국 매사추세츠주 캠브리지 소재 항암제신약 개발사인 블루프린트메디신(Blueprint Medicines, 나스닥 BPMC)의 인산화효소 억제제 ‘아이바키트’(Ayvakit, 성분명 아바프리티닙 avapritinib)가 지난 16일(현지시각) ...
- 2021-06-18
-
- 노바티스 방사성 리간드 ‘177Lu-PSMA-617’ 전립선암 FDA ‘혁신치료제’
- 노바티스의 표적형 방사성 리간드 치료제 ‘177Lu-PSMA-617’이 16일(현지시각) 미국 식품의약국(FDA)으로부터 ‘혁신치료제’로 지정받았다. 이 신약후보는 전이성 거세 저항성 전립선암(mCRPC) 치료제로 3상 ‘...
- 2021-06-16
-
- 우모자바이오파마 시리즈B에서 2억1000만달러 추가 유치, 새 CAR-T 개발
- 작년 11월 5300만달러를 바탕으로 출범한 우모자바이오파마(Umoja Biopharma)가 15일 시리즈B에서 2억1000만달러를 추가 유치함으로써 기존 면역치료법의 한계를 넘어선 새로운 CAR-T 치료제 개발에 나선다. 미국 ...
- 2021-06-16
-
- 노보노디스크 작년 ‘에미스피어’ 18억달러 ‘헐값 인수’ 주장 … 前 주주 손해배상 청구
- 덴마크 노보노디스크의 경구용 당뇨병 치료제 ‘라이벨서스’(Rybelsus 성분명 세마글루타이드 semaglutide)의 매출과 브랜드파워가 상승함에 따라 지난해 11월 6일 미국 뉴저지주 로즈랜드(Roseland) 소재의 약...
- 2021-06-16
-
- 릴리가 받쳐주는 ‘턴스파마슈티컬스’ NASH 신약후보 ‘TERN-101’ 긍정적 2a상
- 출범 당시부터 지난 1월 5일 시리즈C에서 8700만달러를 유치하기까지 릴리아시아벤처스(Lilly Asia Ventures)의 든든한 후원을 받아온 미국 캘리포니아주 포스터시티(Foster City) 소재 턴스파마슈티컬스(Terns Pharmace...
- 2021-06-15
-
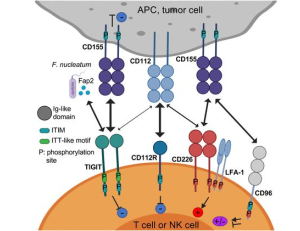
- GSK, 벨기에 아이테오스(iTeos)와 최대 20억 7500만달러에 항암제 인수 거래
- 벨기에 기반 바이오기업인 아이테오스테라퓨틱스(iTeos Therapeutics)는 빅파마 글락소스미스클라인(GSK)으로부터 암 치료제를 공동 개발하고 상업화하기 위해 6억2...
- 2021-06-15
-
- 美 리니지셀, 망막색소상피(RPE) 이식 통해 3명 환자서 조직 재성장 확인
- 미국 캘리포니아주 칼스바드(Carlsbad) 소재 세포치료제 전문기업인 리니지셀테라퓨틱스(Linegage Cell Therapeutics)는 1/2a상 연구에서 지도모양위축(Geographic Atrophy) 또는 건성(위축성) 노인성황반변성(AMD) 환자 3명...
- 2021-06-14
-
- 소아용 1주 제형 성장호르몬 주사제 첫 승인 3개월 뒤로 미뤄져
- 세계 최초의 소아용 1주 제형 성장호르몬 주사제 탄생이 3개월 뒤로 미뤄졌다. 덴마크 코펜하겐에 본사를 둔 혁신 바이오기업 아센디스파마(Ascendis Pharma, 나스닥 ASND)는 TransCon 플랫폼 기술을 활용해 개발한...
- 2021-06-14
-
- 알츠하이머병 신약 ‘아두카누맙’ 승인 논란에, FDA 자문위원 잇따라 사임
- 미국 식품의약국(FDA)이 지난 7일(현지시각) 18년 만에 가까스로 바이오젠의 알츠하이머병 신약 ‘애듀헬름’(Aduhelm 성분명 아두카누맙 aducanumab)을 허가했지만 졸속과 비합리적이라고 판단한 FDA 자문위원 3...
- 2021-06-14
-
- 인사이트 ‘룩소리티닙’ 아토피 승인 지연 … JAK억제제 심장위험 탓
- 미국 델라웨어주 윌밍튼(WILMINGTON) 소재 인사이트코퍼레이션(Incyte Corporation)은 선택적 야누스 인산화효소1(JAK1)/JAK2 저해제 ‘룩소리티닙크림’(ruxolitinib cream)의 아토피피부염 적응증 승인 심사 건이 ...
- 2021-06-14
-
- 中 베이진 ‘브루킨사’ 백혈병 싸움터에서 애브비·J&J ‘임브루비카’ 능가
- 중국 제약사 베이진(BeiGene)의 후발 브루톤티로신키나제(Bruton’s tyrosine kinase, BTK) 억제제 ‘브루킨사캡슐’(Brukinsa, 성분명 자누브루티닙 Zanubrutinib)이 향후 시장 지배력을 가질 수 있음을 시사하는 의미 있...
- 2021-06-14
-
- 화이자 폐렴구균백신 ‘프리베나20’ 승인 … 기존 13가에 7가지 혈청형 추가
- 미국 식품의약국(FDA)은 지난 8일(현지시각) 화이자의 새로운 20가 폐렴구균 백신 ‘프리베나20’(Prevnar 20)을 승인했다. 또 앞서 지난 7일에는 알렉시온(Alexion Pharmaceuticals)의 발작성 야간 혈색소뇨증(Paroxysmal...
- 2021-06-12
-
- 항암제 신약의 향연 ‘ASCO 2021’ … 차세대 CAR-T, 저렴한 브랜드약 가능성 보여
- 지난 4일 개막해 8일에 끝난 올해 미국임상종양학회 연례학술회의(ASCO 2021)에서는 신약후보물질들의 주목받을 임상시험 결과들이 쏟아져 기존 치료제의 아성을 무너뜨릴 기미가 엿보였다. 테마별로 올해 A...
- 2021-06-11
-
- 버텍스, 낭포성섬유증 3중 복합제 ‘트리카프타’ 6~11세로 연령 확장
- 미국 매사추세츠주 보스턴 혁신단지 소재 희귀질환 개발 전문기업 버텍스파마슈티컬스(Vertex Pharmaceuticals)은 낭포성섬유증(cystic fibrosis, CF) 치료제인 ‘트리카프타’(Trikafta, 성분명 엘렉사카프토/아이바카...
- 2021-06-11
-
- 프로메틱 ‘라이플라짐’ FDA 최초 플라스미노겐 결핍증 치료제 승인
- 미국 메릴랜드주 록빌에 소재한 프로메틱바이오테라퓨틱스(ProMetic Biotherapeutics)는 미국 식품의약국(FDA)가 자사의 제1형 플라스미노겐 결핍증 치료제 ‘라이플라짐’(Ryplazim 성분명 인간플라스미노겐-tmvh, h...
- 2021-06-09
-
- 탈 많았던 바이오젠 ‘애듀헬름’ 18년 만에 알츠하이머병 신약으로 FDA 승인
- 바이오젠과 에자이가 비난 여론에도 불구하고 지난해 7월 8일 미국 식품의약국(FDA)에 알츠하이머병(치매) 신약후보물질인 아두카누맙(aducanumab)에 대한 승인 재심사 서류를 제출한 건이 마침내 ‘시판승인...
- 2021-06-09
-
- 美 이튼파마슈티컬스, ‘탈수에탄올’ 메탄올중독증 약은 ‘CRL’ 받고 허가 지연
- 미국 일리노이주 디어파크(DEER PARK) 소재 이튼파마슈티컬스(Eton Pharmaceuticals)의 메탄올 중독 환자를 위한 탈수에탄올 주사제(Dehydrated alcohol injection, DS-100) 주사제는 지난달 28일(현지시각) FDA로부터 화학·제...
- 2021-06-04
-
- 테트라사이클린 내성 극복한 ‘누지라’ CABP 경구전용 투여요법 FDA 승인
- 미국 매사추세츠주 보스턴의 테트라사이클린(Tetracycline) 계열 항생제 전문 개발 제약사인 파라텍파마슈티컬스(Paratek Pharmaceuticals)는 개량형(modernized) 테트라사이클린 계열 항생제인 ‘누지라’(Nuzyra 성분...
- 2021-06-03
- 많이 본 뉴스
-
-
1
한국로슈 발작성 야간 혈색소뇨증(PNH) 희귀질환 신약 ‘피아스카이주’(크로발리맙)’ 국내 허가
-
2
JW중외제약, 리바로 국내 출시 20주년 기념 인포그래픽 공개 … 올 3분기 누적 매출 1413억원, 내년에 ‘리바로페노…
-
3
한국MSD ‘키트루다’, 내년 1월부터 미충족 수요 높았던 소외 암종에 보험급여 확대
-
4
크레스콤, 골연령 분석 AI ‘MediAI-BA’ 美 FDA 510K 허가 획득 … 소아 손가락뼈 X-레이를 5초만에 분석
-
5
사노피, 주1회 투여 지속형 혈우병A 치료제 ‘알투비오주’ 국내 허가
-
6
대한병원의학회 창립, 초대 회장에 신동호 연세대 교수 선출 … 이사장엔 한승준 서울대병원 내과 교수
-
7
한림대 동탄성심병원, 약물 없이 초음파로 알츠하이머 원인 물질 65% 제거
-
8
SK케미칼–넥스트젠바이오사이언스, AI 기반 오픈이노베이션 신약개발 … 후보물질 도출부터 비임상까지 공동 진…
-
9
경북대병원, 비만 환경에서 간암 면역항암치료 저항성 유발 기전 규명
-
10
가톨릭대, 인간 적혈구 기반 비장 표적 생체모사 나노면역치료 플랫폼 개발