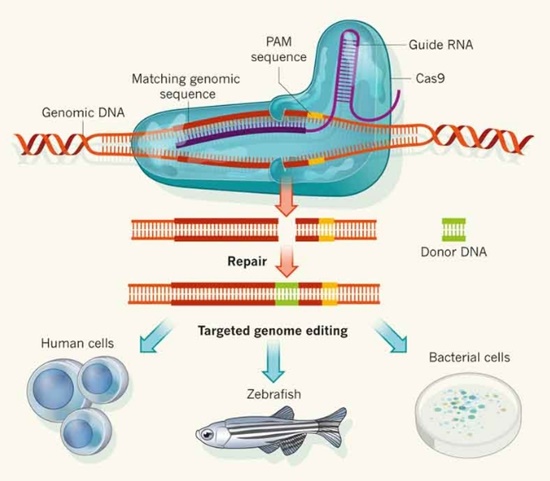
2013년 크리스퍼/카스9 유전자가위(CRISPR/Cas9 nuclease)가 개발되면서 농작물이나 가축의 품종개량, 질병 치료 등 분야에서 유전자교정(genome editing)기술이 급속도로 발전하고 있다. 유전자가위(programmable nuclease)는 DNA 중 특정 염기서열(sequence)을 인식해 표적유전자를 자르고 붙이는 기법을 뜻한다.
유전자교정 기술 전문 국내 기업인 툴젠은 지난달 크리스퍼/카스9 유전자가위를 이용해 사과나무와 포도나무 세포의 병충해 저항력을 강화하는 유전체 교정에 성공해 눈길을 끌었다. 회사 측은 “이번 연구를 통해 유전자가위를 식물세포에 전달·작용시켜 유전체를 교정하는 기간을 줄이고 외부 유전자 도입에 따른 안전성 문제에서 벗어날 수 있게 됐다”고 자평했다.
국내 연구진이 2014년 세계 최초로 인간세포의 유전자 교정에 성공했지만 유전자가위를 이용한 질병치료 연구 분야에서는 후발주자인 유럽, 중국 등에 기술을 추월당할 위기에 처해있다. 생명윤리법 등 규제가 엄격해 연구할 수 있는 대상이 좁게 한정돼있고 국가적 지원정책은 턱없이 부족한 상황이다.
2014년 6월 김진수 기초과학연구원(IBS) 유전체교정연구단장(서울대 화학부 교수), 김동욱 줄기세포기반 신약개발연구단장(연세대 의대 생리학교실 교수), 김종훈 고려대 생명공학부 교수 공동연구팀은 혈우병 환자 세포를 채취한 다음 역분화줄기세포(iPS cell)를 만들고 크리스퍼/카스9 유전자가위를 이용해 뒤집어진 유전자를 교정해 정상으로 되돌리는 데 성공했다.
이를 바탕으로 툴젠이 크리스퍼/카스9 유전자가위를 이용한 혈우병치료제 전임상시험(동물실험)을 진행 중이다.
반면 미국·중국은 이미 사람을 대상으로 한 임상시험에 들어갔다. 유루(Lu You) 중국 쓰촨대 종양학 연구팀은 지난해 10월 세계 최초로 크리스퍼/카스9 유전자가위를 사람에 적용한 임상시험을 시작해 세간의 주목을 받았다. 연구는 말기 폐암 환자 10명의 T면역세포를 추출한 다음 면역관문 유전자인 PD-1(프로그램된 세포사멸 수용체-1, programmed death receptor-1)을 제거한 다음 암세포 공격력이 향상되도록 변형한 T면역세포를 증식시킨 후 다시 환자에게 주입하는 방식으로 진행되고 있다.
미국 국립보건원(NIH) 자문위원회는 지난해 6월 미국 펜실베이니아대 연구팀이 추진하는 크리스퍼 유전자가위를 활용해 암환자를 치료하는 임상시험을 허가했다. 이들 과학자는 식품의약국(FDA)으로부터 최종 승인을 받는대로 암환자 18명을 대상으로 임상시험에 들어갈 계획이다. 환자의 T면역세포를 추출해 유전자를 교정하기로 했다.
3세대 크리스퍼 유전자가위, 만들기 쉽고 정확도 높아
3세대 유전자가위인 크리스퍼/카스9는 염색체 상의 표적 염기서열(20여개의 염기로 구성)에 상보적으로 결합해 이를 인지하는 가이드RNA(guide RNA, gRNA)와 이 유전자 부분을 자르는 카스9 분해효소(nuclease) 단백질로 구성된다. 기존 유전자가위보다 효율성과 정확도가 높다. 2015년 12월 국제 과학저널인 ‘사이언스(Science)’가 뽑은 ‘올해의 혁신기술’로, 1년 후에는 ‘매사추세츠공과대 테크놀로지 리뷰(MIT Technology Review)’가 선정한 ‘세상을 바꿀 10대 기술’로 꼽혔다. 최근에는 카스9 단백질 대신 Cpf1 단백질을 이용해 정확도를 향상시킨 3.5세대 크리스퍼/Cpf1 유전자가위가 개발됐다.
1세대 유전자가위인 징크핑거(ZFN, Zinc figer nuclease)와 2세대 탈렌(TALEN, TAL effector nuclease)은 유전자가위 전문 실험실이 아니면 다루기 힘들어 상용화 가능성이 낮다. 징크핑거와 탈렌은 RNA보다 만들기 복잡한 단백질의 안내를 받아 표적 염기서열을 인식한다. 10개가량의 염기서열만으로 표적 유전자를 인식하다보니 크리스퍼 유전자가위보다 타깃이 아닌 부위도 자를 위험이 높다. 이들은 Fokl 분해효소 단백질을 이용해 특정 유전자 부위를 자른다.
김진수 IBS 단장은 “3세대 크리스퍼/카스9 유전자가위는 기존 기술인 징크핑거 및 탈렌과 달리 연구자가 쉽고 빠르게 만들거나 저렴하게 구입할 수 있어 유전체교정 기법을 민주화시켰다”며 “제약·바이오 산업의 성장을 뒷받침하고 신사업 기회를 창출할 수 있는 혁신기술”이라고 소개했다. 이어 “징크핑거나 탈렌은 유전체 상 표적 염기서열에 맞춰 각 단백질을 생산해야 하므로 복잡한 단백질공학 기술이 필요한 반면 크리스퍼 유전자가위는 카스9 단백질은 그대로 두고 가이드RNA만 손쉽게 만들어 교체하면 되기 때문”이라고 설명했다.
김 교수는 1996년 처음 개발된 이후 2003년부터 유전자교정에 활용된 1세대 유전자가위인 징크핑거, 2011년에 새롭게 등장한 2세대 탈렌에 이어 최근 개발된 크리스퍼/카스9까지 모두 연구한 이 분야의 선구자로 꼽힌다. 1999년에 툴젠을 설립했으며 현재는 이 회사의 기술고문을 맡고 있다. ‘유전자가위(programmable nuclease)’라는 용어의 영어와 한글 둘 다 그가 붙인 이름이다.
크리스퍼 유전자가위는 어떻게 개발됐나
김진수 교수팀이 지난해 1월 한국과학기술연구원 융합연구정책센터 보고서 ‘융합연구리뷰’에 실은 ‘크리스퍼 유전자가위에 의한 생명과학 혁명’에 따르면 ‘크리스퍼’라는 용어는 바이러스 공격에 대항하는 세균(박테리아)의 면역체계에서 나왔다. 다양한 세균 DNA에서 공통적으로 관찰되는 회문 구조의 짧은 반복서열(CRISPR, Clustered Regulary Interspaced Short Palindromic Repeats)을 의미한다. 1987년 일본 연구팀이 대장균 유전자에서 이 반복서열을 처음 발견했다. 2007년 덴마크 연구진은 크리스퍼가 세균의 적응면역(후천면역)으로 인한 현상임을 실험으로 처음 입증했다. 세균은 반복되는 회문 구조의 염기서열 사이에 자신을 공격했던 바이러스의 DNA 중 일부를 기억하고 있다가 같은 종류의 바이러스가 침입하면 빠르게 대응해 면역반응을 보인다.
회문(回文)은 madam이나 nurses run처럼 앞에서부터 읽으나 뒤에서부터 읽으나 같은 단어나 구를 지칭한다. 회문 구조란 두 가닥의 DNA를 어느 쪽으로 읽으나 염기서열이 같은 부분을 말한다. 참고로 우리 몸은 30억쌍의 DNA 염기서열로 이루어져 있다. DNA 유전정보는 4종류의 염기인 아데닌(A), 티아민(T), 구아닌(G), 시토신(C)이 배열된 순서에 따라 결정된다. DNA에 담겨진 유전정보를 RNA 형태로 옮기는 것을 전사(transcription)하고, 이 정보를 바탕으로 단백질을 생합성하는 번역(translation)이 이뤄진다.
2012년 제니퍼 다우드나(Jennifer Doudna) 미국 UC버클리대 교수와 엠마뉘엘 샤르팡티에(Emmanuelle Charpentier) 독일 하노버대 교수 공동 연구팀은 세균의 크리스퍼 적응면역에서 중요한 역할을 하는 카스9 단백질을 발견했다. 세균에 기억된 바이러스 DNA는 RNA로 전사되는데 세균에 있는 카스9 단백질은 이 RNA와 결합해 외부에서 침투한 바이러스 DNA를 인식하고 자른다는 사실을 밝혔다. 이와 함께 카스9 단백질에 결합하는 RNA 염기서열을 바꾸면 바이러스의 유전자가 아닌 다른 유전자도 절단할 수 있음을 보였다.
이 연구결과를 계기로 이듬해 김 교수팀과 미국 연구진 4개팀은 각각 독자개발한 크리스퍼 유전자가위 기술에 관한 연구논문을 거의 동시에 발표했다.
학계는 3세대 크리스퍼/카스9 유전자가위는 RNA가 표적 염기서열을 인식해 자르는 과정이 차별화된다고 평가하고 세균의 적응면역 시스템인 크리스퍼를 이용한 ‘알젠’(RGEN, RNA-guided Engineered Nucleases)으로 부르기도 한다.
크리스퍼 유전자가위 관련 쟁점 … 기술특허·안전성·윤리
크리스퍼 유전자가위 기술이 품종개량, 신약개발 등 다양한 산업 분야에 적용될 기미가 보이자 특허 분쟁도 뜨겁다. 툴젠은 원천기술 개발 관련 전세계 특허권 확보를 두고 미국 UC버클리대, 브로드연구소(매사추세츠공과대(MIT)·하버드대) 등과 경쟁하고 있다.
유전자가위로 교정한 작물이 유전자변형농산물(GMO)처럼 심한 반대 여론에 부딪힐지 안전한 유전공학 기술을 적용한 새로운 식품으로 인정받을지도 관건이다. 유전자가위 기술 도입에 긍정적인 연구진들은 GMO는 다른 생물의 유전자를 삽입하지만 유전자가위 교정 작물은 생물 고유의 유전체 중 일부를 약간 편집하는 수준이라 안전성 측면에서 이 둘을 구분해야 한다고 주장하고 있다. 유전자재조합 농산물이지만 GMO만큼 엄격한 규제를 적용할 필요가 없다는 것이다.
인간 배아세포를 유전자교정 연구에 허용할 것인가에 대해 찬반 의견이 대립되는 가운데 지난해 초 영국 인간생식배아관리국(HFEA)은 국가기관 중 최초로 유전자가위를 이용한 인간 배아의 유전자교정 연구를 허가했다. 국내에서는 생명윤리법에 따라 유전자교정 연구에 배아를 활용할 수 없는 상황이다. 2015년 12월 미국과학아카데미, 영국 로열소사이어티, 중국과학아카데미 등이 주관해 미국 워싱턴에서 열린 ‘인간유전자교정 국제정상회의’에 참석한 전문가들은 기초연구에 한해 유전자교정을 활용하는 쪽으로 의견을 모았다.
크리스퍼 유전자가위는 기존의 것보다 정확도가 향상됐더라도 여전히 오작동(off-target) 위험이 높다. 현재 기술로는 100% 의도한대로 유전자가 잘리지 않아 예상치 못한 결과가 발생할 수 있다. 이에 과학자들은 유전자교정 기술 적용에 관해 매우 신중한 태도를 보이고 있다. 2015년 3월 준 쥬황(Junjiu Huang) 중국 중산대 연구팀은 86개의 생육이 불가능한 인간 수정란·배아에 크리스퍼/카스9 유전자가위를 적용한 결과 28개에서만 특정 염기서열 부위가 절단된 것으로 확인했다.
일각에서는 유전자가위를 활용하면 고유의 유전체 중 극히 일부를 교정하는 수준을 넘어 외래 유전자 삽입도 가능하므로 유전자교정 기술이 아닌 유전자편집 기술로 부를 것을 제시하기도 했다. 유전자교정은 유전자가위의 응용 범위와 안전성 문제를 축소해 인식할 소지가 있다는 지적에서다.

