- 코데인 투여받은 소아 중 3건 사망사례 및 1건의 호흡저하 사례 나타나
식품의약품안전청은 수술 후 진통제 등으로 사용되는 마약성 진통제 ‘코데인(codeine)’ 함유제제에 대해 소아의 호흡곤란 또는 사망 등 생명을 위협하는 부작용 발생의 위험이 있어 폐쇄성 수면무호흡증 치료로 편도절제나 인두편도절제술을 받는 소아에게 다른 진통제 처방을 고려하라는 내용의 안전성 서한을 17일 배포했다.
이번 안전성 서한은 미국 식품의약국(FDA)의 코데인 함유 제제의 부작용 보고자료 등을 검토한 결과에 따른 것이다. FDA가 최근 코데인 함유 제제에 대한 의학문헌을 검토한 결과, 폐쇄성 수면무호흡증 치료를 위해 편도절제술 후 진통제로 코데인을 투여 받은 소아 중 3건의 사망사례 및 1건의 생명을 위협하는 호흡저하 사례가 나타나 소아에게 처방 시 위험성을 인지하고 최단기간 동안 최소량을 사용할 것을 당부했다.
아울러 유전적으로 코데인을 모르핀(morphine)으로 전환하는 효소가 더 활성화돼있는 ‘매우 빠른 대사능력자(Ultra-rapid Metabolizers)’의 경우, 코데인 함유제제를 복용했을 때 높은 모르핀 농도로 인해 호흡곤란 및 사망위험이 높아질 수 있다고 밝혔다.
식약청 관계자는 “국내 유통품목의 허가사항에 영아의 호흡곤란과 관련한 일부 내용이 반영돼 있다”며 “이번 정보사항과 관련된 국외 조치동향 및 안전성·유효성에 대한 전반적인 검토를 실시해 허가사항에 반영할 예정”이라고 말했다.
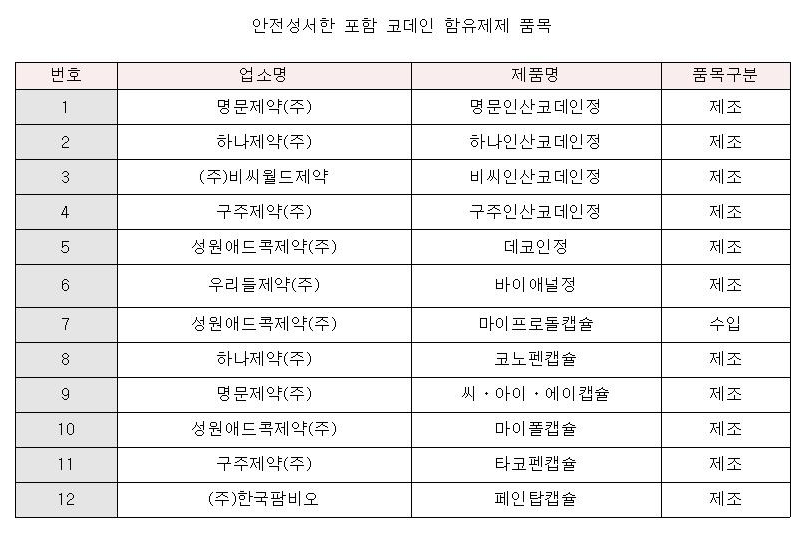
이번 안전성서한에 포함되는 제품은 7개 제약사의 12개 품목이다.