 FDA는 트랜스티레틴 아밀로이드성 심근병증(ATTR-CM) 치료제로 브릿지바이오파마의 (BridgeBio Pharma)의 아트루비(Attruby, 아코라미디스 acoramidis)를 승인했다.
FDA는 트랜스티레틴 아밀로이드성 심근병증(ATTR-CM) 치료제로 브릿지바이오파마의 (BridgeBio Pharma)의 아트루비(Attruby, 아코라미디스 acoramidis)를 승인했다.
이에따라 화이자의 빈다켈(Vyndaqel)과 빈다맥스(Vyndamax)가 2019년 승인받은 이후 미국시장에서 ATTR-CM 환자를 위한 유일한 치료제로 구축해온 독점구조는 종료돼고 약 5년만에 경쟁체제로 전환된다.
브릿지바이오는 22일 ATTR-CM 성인 환자의 심혈관 사망과 심혈관 관련 입원을 줄이기 위한 경구제제 아트루비가 승인을 받았다고 발표했다. 당초 승인결정예정일은 29일이었으나 일주일 앞서 승인을 받았다.
승인은 증상이 있는 632명의 ATTR-CM 환자를 대상으로 진행된 ATTRibute-CM 3상(NCT03860935)이 기반이다. 1일 2회 아트루비를 경구투약한 참가자는 위약대비 30개월 간 모든윈인 사망률과 심혈관 관련 입원율이 42%로 감소했다. 입원의 빈도는 50%가 줄었다.
약가는 한달(28일)에 1만 8759.12달러(한화 약 2600만원)이 책정됐다. 연간으로는 한화로 3억원을 훌쩍 넘긴다. 빈다켈과 빈다맥스의 연간 3억원 초반대 약가보다 더 비싸게 책정됐다. 담 임상참가자에게는 평생 무상공급을 약속했다.
브릿지바이오는 미국과 유럽의 50만명 이상의 ATTR-CM 환자 대상으로 최대 15~20억 달러의 매출을 올릴 수 있을 것으로 기대했다.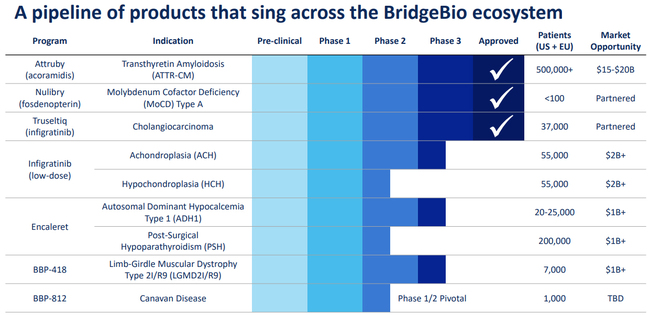 출처 브릿지 바이오, 아트루비는 FDA 승인 3번째 품목이다.
출처 브릿지 바이오, 아트루비는 FDA 승인 3번째 품목이다.
유럽에서 승인도 검토가 진행중이며 25년 중으로 승인여부에 대한 결정이 이뤄질 것으로 기대했다. 유럽에서는 해당지역 판권을 인수한 바이엘이 판매를 담당할 예정이다. 바이엘은 지난 3월 선불금을 포함 단기마일스톤으로 3억 1천만달러에에 유럽판권을 인수 한바 있다.
유럽에서는 빈다켈과 빈다맥스는 ATTR-CM과 트랜스티레틴 아밀로이드 다발신경병증(ATTR-PN) 등 두가지 적응증으로 승인을 받았다. 유럽승인시 ATTR-CM 영역에서 첫 경쟁자를 맞이하게 된다.
ATTR-CM과 달리 ATTR-PN의 경우 이미 다수의 경쟁자가 있다. 앨라일람의 '온파트로(Onpattro 파티시란)와 암부트라(Amvuttra 부트리시란), 아스트라제네카와 아이오니스의 와인누아((Wainua 에플론테센) 등이다.
한편 국내의 경우 유럽승인을 기반으로 빈다켈과 빈다맥스가 각각 ATTR-PN과 ATTR-CM에 대해 적응증을 따로 갖고 있다. 국내의 경우 지난 15일 ATTR-PN을 적응증으로 암부트라가 식약처 승인을 받아 빈다켈과 경쟁구도가 형성됐다.
빈다켈과 빈다맥스는 타파미디스 성분을 공유하고 염을 달리하는 치료제로 ATTR-PN의 경우 20mg 용량의 빈다켈을 1일 1회 투약하나 ATTR-CM치료시 1일 4회 복용해야 한다. 빈다맥스는 ATTR-CM치료시 1정(61mg)을 1정복용하는 편의성을 갖는다. 국내 적응증이 좀 더 합리적인 구조다.