- 다국적 임상 56%‧국내 임상 19% 늘어 … 임상시험 지역·기관 편중현상 여전
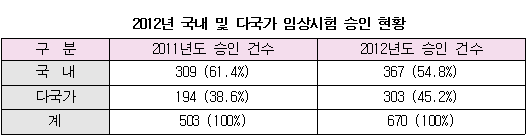
지난해 임상시험 승인건수는 총670건으로 2011년(503건)보다 33.2% 증가한 것으로 나타났다. 식품의약품안전청은 2012년 임상시험계획서 승인현황을 분석해 이같은 결과가 나왔다고 6일 밝혔다. 식약청은 승인건수 증가 원인을 다국적‧국내 제약사의 투자확대, 국내 임상시험 인프라 확대, 임상시험 관련 규정의 국제조화 등으로 분석했다.
지난해 승인된 임상시험 주요 특징은 △다국가 임상시험 증가 추세 △종양·만성성인병 치료제 중심 △초기단계 임상시험 급증 △임상시험의 서울·경기지역 편중 등이다.
국내 임상시험은 정부차원의 신약개발 연구지원 확대로 개량신약, 복합제 등 개발이 활성화됨에 따라 2011년 309건에서 2012년 367건으로 전년대비 18.8% 증가하는 등 매년 증가 추세를 보이고 있다. 다국가 임상시험은 글로벌 경제위기로 인한 신약개발 중단, 인수합병 등으로 2009년 202건, 2010년 210건, 2011년 194건 등 감소세를 보였지만 국제경기가 일부 회복된 2012년에는 303건으로 전년에 비해 56%가량 급증했다. 국내 임상시험은 국내 제약사가 의약품을 개발해 국내에서 실시하는 임상시험이다. 다국가 임상시험은 다국적 제약사가 의약품을 개발해 전세계를 대상으로 실시하는 임상시험이다.
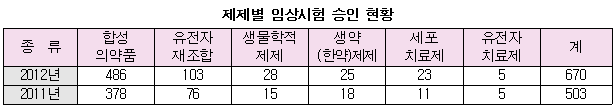
지난해 임상시험 승인건수는 합성의약품이 486건(72.5%)로 가장 많았고, 유전자재조합의약품(바이오의약품)이 103건(15.3%)로 뒤를 이었다. 유전자재조합의약품은 바이오시밀러 제품 개발 활성화 등으로 2011년(76건)보다 35.5% 증가했다. 이밖에 백신 등 생물학적제제는 2011년 15건에서 2012년 28건으로, 세포치료제는 2011년 11건에서 2012년 23건으로 증가했다.
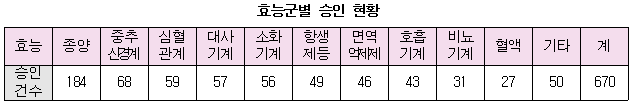
치료영역별 임상시험 승인건수는 항암제 184건(27.5%), 중추신경계 68건(10.1%), 심혈관계 59건(8.8%), 호르몬·대사기계 57건(8.5%), 소화기계 56건(8.4%) 순이었다. 항암제는 2009년 101건, 2010 112건, 2011년 112건으로 승인 건수가 주춤하다가 지난해 156건으로 증가했다. 국내 임상시험은 항암제 64건, 심혈관계 46건, 소화기계 44건, 호르몬‧대사기계 38건, 중추신경계 35건 순이었다. 다국가 임상시험은 항암제 92건, 중추신경계 33건, 면역억제제 33건, 항생제 28건, 호흡기계 23건 순이었다.
식약청 관계자는 “최근 제약사들이 서구화된 식습관과 고령화 사회 등에 따른 국내 질병의 변화에 맞춰 항암제와 만성성인병 치료제의 개발에 주력하는 추세”라며 “국내 연구개발(R&D) 추세가 개량신약, 새로운 조성의 복합제 등의 개발경향이 두드러지면서 다른 의약품에 비해 상대적으로 의약품시장이 큰 심혈관치료제의 개발에 주력하고 있다”고 말했다.
임상단계별로는 1상이 160건(24%), 2상은 105건(16%), 3상이 227건(34%)이었다. 국내 임상시험의 경우 1상 128건, 3상 47건, 2상 30건 순이었다. 다국가 임상시험은 3상 180건, 2상 75건, 1상 32건 순이었다. 학술목적으로 연구자가 주도하는 연구자 임상은 2010년도 99건, 2011년 105건에서 지난해 172건으로 증가했다.
임상시험 지역·기관 편중현상은 여전한 것으로 나타났다. 지난해 승인된 임상시험 중 약70%는 서울(55%)과 경기도(14%) 지역에서 실시됐다. 이밖에 부산(7%), 인천(5%), 대구(4.6%), 대전(3%) 등의 순으로 실시됐다. 임상시험 실시기관은 서울대병원 210건, 울산대 서울아산병원 199건, 성균관대 삼성서울병원 189건, 연세대 신촌세브란스병원 182건, 가톨릭대 서울성모병원 119건 순으로 이들 5대 대형병원의 임상시험 점유율이 35.3%에 달했다.
식약청 관계자는 “임상시험 분야의 국제경쟁력과 피험자에 대한 안전을 강화하기 위해 2000년대 초반부터 임상시험계획승인(IND) 제도와 국제 수준의 임상시험관리기준(GCP)을 도입하는 등 국제조화를 위해 노력하고 있다”며 “규제 선진화, 전문인력 체계적 양성, 임상시험 종사자의 윤리강화 등을 통해 임상시험의 국제경쟁력을 높여 세계 5대 임상국가로 발돋움하는 것을 적극 지원할 계획”이라고 말했다.