노보노디스크는 개발이 진행 중인 1일 1회 경구용 ‘위고비’(세마글루타이드) 25mg의 효능과 안전성을 평가한 3상 ‘OASIS 4’ 임상시험의 최종 결과를 의학 학술지 ‘뉴잉글랜드저널오브 메디신’(NEJM)에 17일(현지시각) 게재했다.
위고비 주사제의 허가 용량은 0.25mg, 0.5mg, 1.0mg, 1.7mg, 2.4mg으로 주 1회 피하주사한다. 가장 낮은 용량인 0.25mg를 16주간 투여한 다음 점진적으로 최대 2.4mg까지 증량하는 방식으로 치료가 진행된다. 경구제는 주사제에 비해 소화 및 흡수되는 과정에서 낭비되는 양이 많기 때문에 더 많은 양을 투여해야 주사제와 대등한 효과를 기대할 수 있다. 세마글루타이드 성분의 당뇨병 치료제인 ‘리벨서스정’은 하루에 한번 3mg, 7mg, 14mg 중 한 가지를 복용하게 돼 있다. 다만 경구약은 주사제에 비해 주사제에 대한 거부감, 주사부위 국소반응 등을 피할 수 있는 게 장점이다.
이 임상은 세마글루타이드 25mg을 1일 1회 복용하면서 라이프스타일 개선을 병행한 총 307명의 ‘비만’ 환자 또는 한 가지 이상의 체중 관련 동반질환(당뇨병은 제외)을 가진 ‘과다체중자’를 대상으로 64주 동안 위약대조군과 비교 평가했다.
임상 결과 복약법을 성실하게 이행했을 때 위고비 투여군은 64주차에 체중이 평균 16.6% 감소한 반면 위약군은 2.7% 감소에 그쳤다. 또 위고비 투여군은 체중이 20% 이상 감소한 비율이 34.4%로 위약군의 2.9%와 현저한 격차를 보였다. 세마글루타이드 피하주사제의 체중감량 효과는 약 20% 선이다.
복약 준수 이행 여부와 무관하게 위고비 군은 64주차에 체중이 평균 13.6% 감소한 반면 위약 대조군은 2.2%에 그쳤다. 체중이 20% 이상 감소한 비율은 각각 29.7%, 3.3%로 뚜렷한 차이를 보였다.
이밖에 위고비 투여군은 심혈관계 위험요인들의 개선, 활동적인 일상생활의 영위 측면에서 위약군보다 우위를 보였다.
경구용 위고비의 안전성‧내약성 프로필을 보면 앞서 주사제형 ‘위고비’에서 관찰되었던 내용들과 대체로 일치했다.
OASIS 4 임상시험에서 경구용 위고비 25mg의 위장관계 부작용을 보면 중증도 측면에서 경도~중등도였고, 일시적이었다. 가장 흔한 부작용은 구역(또는 오심, 46.6% 대 위약 18.6%), 구토(30.9% 대 위약 5.9%)였다. 이는 주사제 최고 용량인 2.4mg과 단순 비교했을 때 구역(43.9% 대 위약 16.1%), 구토(24.5% 대 6.3%)보다 다소 부작용 발생 비율이 높지만 통계적으로 유의하지는 않은 것으로 파악된다.
약물 복용 중단으로 이어진 부작용이 발생한 비율을 보면 경구용 위고비 25mg 복용군이 6.9%, 위약 대조군이 5.9%로 각각 집계됐다. 이에 비해 2.4mg 위고비 피하주사의 약물 중단 비율은 5.8%(위장관 부작용으로 투여 중단한 사례는 4.3%, 다양한 용량으로는 약 4~5% 수준)이었다.
중증 부작용은 경구용 ‘위고비’ 25mg 복용그룹에서 3.9%, 플라시보 대조그룹에서 8.8%로 파악됐다. 한 메타분석에 따르면 2.4mg 위고비 피하주사의 중증 부작용 발생 비율은 8.94%(위약 6.29%)로 집계된 바 있다.
이 같은 안전성‧내약성 프로필은 총 3700만 환자년수(patient-years)에서 입증된 내용과 궤를 같이하는 것이다.
노보노디스크의 마르틴 홀스트 랑게(Martin Holst Lange) 연구개발 담당 부회장 겸 최고과학책임자는 “경구용 위고비 25mg에서 도출된 데이터는 경구용 체중관리제로서 압도적인 효능이 나타났다”면서 “체중이 평균 16.6% 감소한 데다 안전성‧내약성 프로필은 기존의 주사제와 비견할 만한 것으로 나타났기 때문”이라고 말했다. 이어 “현재 미국 내 비만환자들 가운데 2% 미만이 비만 치료제를 복용하고 있는 형편”이라며 “정제형 위고비가 경구용 치료제로 환자들의 선호도에 부응할 수 있을 것”이라고 전망했다.
그는 “현재 경구용 세마글루타이드가 FDA 심사 중”이라며 “허가를 취득하기 전에 충분한 공급이 이루어져 미국 내 예상수요를 충족시킬 것”이라고 덧붙였다. 이어 “경구용 세마글루타이드가 과다체중자 또는 비만 환자를 위한 새로운 치료제 표준이 되길 희망한다”고 속내를 드러냈다.
OASIS 4 임상시험의 제1저자인 캐나다 온타리오주 벌링턴 소재 워튼메디컬클리닉(Wharton Medical Clinic)의 션 워튼(Sean Wharton) 의학이사는 “이번 임상에서 세마글루타이드는 지속가능한 체중감소 효과와 포괄적인 건강 유익성의 괄목할 만한 영향력을 강조한다”며 “경구용 세마글루타이드 25mg은 제형의 검증된 효능과 탄탄하게 확립된 안전성‧내약성 프로필을 기반으로 개발된 것이어서 비만 치료제의 상당한 발전을 의미한다”고 강조했다. 그는 경구용 세마글루타이드 치료제는 (주사제라는 이유로) 치료를 받지 않는 환자에게 GLP-1 제제로 치료를 시작하는 새 치료옵션이 될 것이라고 덧붙였다.
노보노디스크는 올해 2월 1일 1회 경구복용형 ‘위고비’의 허가신청서를 FDA에 제출한 바 있다. 이는 석 달 후인 올해 5월 2일 FDA에 접수돼 현재 심사가 진행 중이다. 올해 4분기 안에 승인 여부가 결정될 전망이다. 노보노디스크는 승인에 대비해 이미 미국 현지 제조시설에서 경구용 위고비 생산을 준비 중이다. 도널드 트럼프의 미국 내 의약품 생산 유도 정책에 따라 생산공정이 100% 미국에서 진행된다고 노보노디스크는 보도자료에 명시했다. 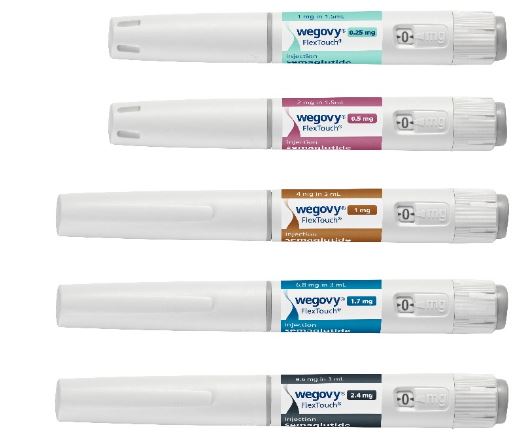
한편 4건의 연구(무작위 대조시험 1건(전향적 연구), 후향적 연구 3건)를 메타분석한 연구결과(총 559명의 환자, 경구 투여 257명, 피하 투여 302명)에 따르면 피하주사 세마글루타이드는 경구 세마글루타이드에 비해 당화혈색소(HbA1c) 감소 효과가 유의미하게 더 컸다.
체중 감소 효과는 수치적으로 피하주사가 더 컸지만 통계적으로 유의미한 차이는 없었다. 경구제가 피하주사 대비 치료 중단위험이 유의하게 높았다. 상대위험비가 1.79로 치료 중단위험이 79% 더 높은 것으로 추정됐다. 환자가 어떤 제형을 선택하느냐는 치료 순응도, 개인적인 선호도, 동반질환, 경제적 비용, 시간 절약 등을 감안해야 한다. 그럼에도 불구하고 경구약은 주사제에 비해 절대적으로 많은 양을 경구 투여하므로 위장관 부작용을 포함한 내약성을 지속적으로 모니터링할 필요가 있다.
션 워튼은 위고비 피하주사제를 기존 2.5mg의 3배인 7.5mg으로 올린 'STEP UP' 임상시험의 주요 결과를 15일 의학 학술지 '란셋'(Lancet)에 게재했다. 노보노디스크는 지난 7월 유럽연합 규제당국에 고용량 위고비 허가 신청서를 제출했으며, 미국을 포함한 다른 국가에서도 허가 신청을 검토 중이다.
이 임상에는 당뇨병이 없고 BMI(체질량지수)가 30kg/m² 이상인 성인 1407명(평균 연령 47세)이 참여했다. 참가자 중 73.7%가 여성이었고, 참가자들의 평균 체중과 BMI는 각각 113kg, 39.9kg/m²였다. 연구진은 참가자를 5:1:1 비율로 위고비 7.2mg 투여군, 2.4mg 투여군, 또는 위약군에 무작위로 배정했다.
연구 결과, 위고비 7.2mg 투여군은 투여 72주 후 평균 18.7%의 체중 감량 효과가 나타났다. 이는 위고비 2.4mg 투여군의 평균 체중 감량 효과인 15.6%보다 높은 수치다. 반면 위약은 3.9%에 그쳤다.
약물의 용량을 높일수록 위장관 부작용의 빈도가 더 자주 나타났다. 위고비 7.2mg 투여군 중 70.8%가 위장관 부작용을 경험한 반면, 위고비 2.4mg 투여군과 위약군은 각각 61.2%·42.8%가 위장관 부작용을 경험했다.
높은 약물 용량으로 인해 주사 시 피부 불편감·통증 등 감각 이상을 경험한 비율도 고용량 투여군이 22.9%로 가장 높았다. 반면 2.4mg 투여군과 위약군의 감각 이상 경험 비율은 각각 6%, 0.5%였다.
그럼에도 워튼 교수는 고용량 위고비의 체중 감량 이점이 부작용 위험 대비 높다며 위고비를 두둔하는 결론을 내렸다. 그렇지 않아도 GLP-1 제제의 부작용에 대한 우려가 높은 가운데 유럽연합 보건당국이 고용량 위고비 피하주사를 허가할지 궁금하다.
참고로 위고비의 경쟁약인 릴리의 GIP 및 GLP-1 이중 작용제인 '마운자로'(성분명 티어제파타이드) 의 최고 용량은 15mg이며 72주차에 22.5%의 체중감량 효과를 보였다.
글로벌 경구용 GLP-1 계열 비만치료제 시장 경쟁 구도
릴리는 하루 한 알 복용하는 경구용 글루카곤 유사 펩타이드-1(GLP-1) 수용체 작용제 ‘오르포글리프론’(orforglipron)이 3상 ‘ATTAIN-2’ 임상시험에서 복용 72주 후 체중이 10.5% 감소한다는 긍정적인 연구결과는 지난 8월 26일 발표한 바 있다.
미국 머크(MSD)는 2024년 12월, 중국 한소파마(Hansoh Pharma)와 경구용 소분자 GLP-1 작용제인 HS-10535를 도입하고 1상 착수를 준비 중이다.
아스트라제네카는 2023년 11월, 중국 상하이 기반의 제약사 (Eccogene)과 비만, 제2형 당뇨병 및 기타 심장대사 질환을 위해 개발 중인 차세대 경구용 글루카곤 유사 펩타이드 1 수용체 작용제(GLP-1RA)인 ECC5004에 대한 중화권 외 글로벌 독점 라이선스를 확보했다. ECC5004는 하루에 한 번 먹는 알약 형태로 미국에서 1상이 진행되고 있다. 1상에서 유망한 체중 감량 신호와 유리한 안전성 프로필을 보여줬다. 현재 2상 시작을 준비 중이다.
로슈는 미국 캘리포니아주 버클리에 소재한 민간 제약기업 카못테라퓨틱스(Carmot Therapeutics)를 2023년 12월 5일, 27억달러에 인수하고 다수의 주사용 이중 GLP-1/GIP 수용체 작용제를 확보했다. 로슈는 이들 신약후보를 자사의 항미오스타틴 항체와 병용해 체중 감량 시 일반적으로 나타나는 근육 손실을 줄이는 데 주력하고 있다.
당시 로슈는 ‘CT-388’ ‘CT-868’ ‘CT-996’ 등 3개 신약후보를 확보했는데 이 중 CT-966이 경구용 GLP-1 작용제다. CT-966은 작년 7월에 발표된 1상 임상시험 결과, 당뇨병이 없는 비만 환자를 대상으로 4주 이내에 위약 대비 평균 체중 감소 효과(위약 보정 통계치)가 6.1%로 나타났다. 로슈가 주사제 및 경구제에서 신약개발에 성공한다면 릴리나 노보노디스크를 위협한 가장 강력한 경쟁자로 지목된다.
화이자는 1일 2회 경구용 GLP-1 작용제로 다누글리프론(danuglipron)을 개발하다가 2상 결과 내약성이 좋지 않은 것으로 나타나 개발을 중단한 상태다.

