 사노피는 경구용 BTK억제제 톨레브루티닙(Tolebrutinib)이 비재발성 이차진행형 다발성경화증(non-relapsing secondary progressive multiple sclerosis, nrSPMS) 환자에서 장애 진행을 유의하게 지연시켰다는 임상 3상 결과를 8일 발표했다.
사노피는 경구용 BTK억제제 톨레브루티닙(Tolebrutinib)이 비재발성 이차진행형 다발성경화증(non-relapsing secondary progressive multiple sclerosis, nrSPMS) 환자에서 장애 진행을 유의하게 지연시켰다는 임상 3상 결과를 8일 발표했다.
툴레브루티닙은 동일 적응증으로 3월 25일 FDA 승인신청이 우선심사 경로로 수락돼 승인결정일은 9월 28일로 잡혀있으며 유럽 규제검토도 진행중인 후보약물이다.
적응증은 기존치료제가 보유한 일차 진행성 다발성경화증(PPMS)와 재발형 다발성 경화증(SPMS)의 중간지점인 질병이 재발하지 않고 장애가 진행되는 nrSPMA다. 승인된다면 해당질환상태의 환자를 위한 첫 치료옵션이 된다.
HERCULES 3상(NCT04411641)은 비재발성 2차 진행성 다발성경화증환자 1131명 대상으로 투약 6개월차 신경계 손상에 따른 확정된 장애의 진행(confirmed disability progression, CDP)을 위약대비 지연시키며 1차 평가지표를 달성했다. 위험비는 0.69로 장애의 발생시기를 31%를 늦췄다.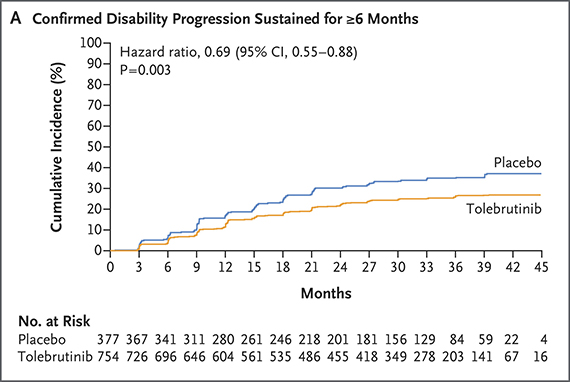 출처: NEJM
출처: NEJM
연구결과는 지난해 9월 코펜하겐에서 열린 유럽다발성경화증학회(ECTRIMS)에서 첫 발표됐고, 4월 열린 미국신경학회(AAN)와 뉴잉글랜드저널오브메디신(New England Journal of Medicine, NEJM)에 동시 게재됐다.
연구를 주도한 미국 클리블랜드클리닉 신경과학연구소의 로버트 폭스(Robert Fox) 박사는 "이번 결과는 치료 옵션이 없던 nrSPMS 환자에게 있어 새로운 전환점을 의미한다"고 평가했다.
이어 레브루티닙은 뇌혈관장벽(Blood Brain Barrier, BBB)을 통과, 중추신경계 내 미세아교세포(microglia) 및 B세포를 조절하는 기전으로 기존 다발성경화증 치료제가 주로 말초 B세포와 T세포를 타깃으로 하는 것과 차별화된다고 덧붙였다.
같은날 재발형 다발성경화증 환자대상으로 진행한 GEMINI 1 및 2((NCT04410978/NCT04410991) 두건의 병행 3상 결과도 함께 발표했다. 1차 평가지표인 연간 재발률(Annualized Relapse Rate, ARR)에서 기존 치료제 테리플루노마이드(Teriflunomide/오바지오) 대비 우월성을 입증하지는 못했다. GEMINI 1에서는 톨레브루티닙군과 테리플루노마이드군의 ARR이 각각 0.13과 0.12로 나타났으며, GEMINI 2에서는 모두 0.11로 동일했다.
다만 두 임상에 대한 통합 분석에서 톨레브루티닙은 테리플루노마이드 대비 6개월 확정 장애 악화(CDW) 발생 시점을 29% 지연시키는 것으로 나타났다. HERCULES 3상과 유사한 장애지현 효과다.
안전성 측면에서는 간 효소 수치 상승이 톨레브루티닙군에서 일부 관찰됐다. HERCULES 연구에서는 4%의 환자에서 3배 이상 상승, 0.5%에서는 20배 이상 상승이 보고됐으며 대부분 치료 초기 90일 내 발생했다. 간 이식이 필요한 중증 사례 1건이 있었으며, 이후 간 효소 수치에 대한 더 빈번한 모니터링이 도입됐다.
GEMINI 1·2 임상의 통합 안전성 분석에서도 두 약물군 간 이상반응 발생률은 대체로 유사했으며, 간 효소 상승은 톨레브루티닙군에서 5.6%, 테리플루노마이드군에서 6.3%로 나타났다. 사망률은 두 군에서 각각 0.1%와 0.2%로 치료와의 관련성은 없는 것으로 평가됐다.
사노피는 톨레브루티닙에 대한 일차 진행형 다발성경화증(primary progressive MS)을 대상으로도 임상 3상을 진행 중에 있다. 일차 진행성 다발경화증 치료제는 로슈의 오크레부스가 유일하다.

