2000년대 등장한 단백질인산화효소 억제제(protein kinase inhibitor) 관련 표적치료제는 EGFR, RAS-RAF-MEK-ERK 등 다양한 신호전달체계 중 하나를 차단한다. 그 중 가장 많은 신약을 상품화한 한 게 EGFR 억제제였지만 2013~2015년에 가장 많은 신약후보물질이 도출된 것은 PI3K/AKT/mTOR 경로 억제제다. 전세계적으로 2013년에 35개, 2014년 40개, 2015년엔 27개가 쏟아졌다.
mTOR는 포유류 라파마이신 표적(mammalian target of rapamycin)의 약어로 FK506 binding protein 12-rapamycin associated protein 1(FRAP1), RAFT1으로도 알려졌다.
mTOR는 라파마이신(rapamycin, 시롤리무스·Sirolimus과 동의어, 대표적 상품명 라파뮨정) 기전을 연구하는 과정에서 발견됐다. 1970년대 초 캐나다의 한 의료탐험대는 칠레령의 이스터섬에서 토양을 채취해 갔다. 이 토양 샘플에서 항진균력이 매우 강한 스트렙토마이시스 하이그로스코피쿠스(Streptomyces Hygroscopicus)라는 박테리아를 발견했다. 이후 이 약을 이스터섬을 뜻하는 토착어 라파누이(Rapa Nui)란 이름을 따서 라파마이신이라고 명명했다.
라파마이신은 마이크롤라이드계 항생제로 심장스텐트 삽입 후 스텐트와 심장혈관 간 협착증을 예방하기 위해 스텐트 외막 코팅재로도 단골로 사용되고 있다.
처음에는 항진균제로 쓰였던 라파마이신의 기전을 연구 과정에서 라파마이신이 mTOR를 억제하는 것을 밝혀냈고, 크게 보면 세린/트레오닌 단백질 인산화효소(serine/threonine-specific protein kinase) 캐스케이드 중 mTOR가 PI3K-Akt-mTOR 경로의 일원임을 발견했다. FKBP12-라파마이신 복합체(FK binding protein12-rapamycin complex)가 mTOR의 FKBP12-라파마이신 결합(FKBP12-rapamycin binding, FRB 또는 Rheb) 도메인에 결합했을 때 일어나는 효소 작용의 주체가 바로 mTOR이다. TORC1(mTOR complex 1)과 mTORC2(mTOR complex 2)로 구분한다.
mTORC1은 mTOR, raptor(regulatory-associated protein of mTOR), MLST8(GβL:G protein β-subunit like protein이라고도 함), PRAS40, DEPTOR 등으로 구성된다. 여러 신호 자극을 받아 성장인자, 체내 에너지, 풍부한 영양분 이용률과 산소, 활성산소, DNA손상 등의 환경이 갖춰지면 mTORC1세포 내부에서 mRNA 번역에 의한 단백질 합성이 촉진된다. 리보솜이 생성되고 자가포식 현상을 억제한다. 이들 작용은 라파마이신에 의해 억제될 수 있다.
mTORC2는 mTOR, MLST8(GβL), RICTOR (rapamycin-independent companion of mTOR), mSin1(mammalian stress-activated protein kinase interacting protein 1) 등으로 이뤄진다. 세포의 골격을 구성 및 조절하고, Akt 활성화를 촉진한다. 라파마이신에는 반응하지 않는다. Akt는 mTORC1의 활성을 조절하며 mTORC1과 mTORC2의 작용기전이 중첩되는 순환고리 역할을 한다.
PI3K-Akt-mTOR 경로는 세포 내부의 다양한 신호전달체계와 연결돼 서로 상호작용한다. mTOR의 상위 기전인 PI3K 효소의 경우 PTEN(phosphatase and tensin homolog)의 작용으로 PIP3 형성 과정이 억제된다.
T세포 억제해 면역거부반응 줄여, 인산화 신호전달 차단해 암 성장 눌러
mTOR 억제제들은 서로 화학적으로 유사하며 같은 작용 기전을 가지고 있다. 세포질 내로 흡수돼 mTOR 세포 내 수용체인 FKBP12와 결합해 mTOR를 선택적으로 억제한다.
mTOR 억제는 세포 주기 진행과 세포 성장을 결정하는 세포 내 신호전달 체계에 큰 영향을 미친다. 따라서 mTORC1은 세포분열시 DNA합성 준비단계인 G1에서 DNA 합성 준비기인 S기로 넘어가는 T림프구의 세포 주기를 차단함으로써 면역억제 효과를 가진다. 1세대 mTOR 억제제는 mTORC1 경로에 관여해 내피세포, 섬유아세포, 평활근세포 등 다양한 세포 성장을 억제한다. 2세대 mTOR 억제제는 mTOR/PI3K 이중억제제와 mTORC1/mTORC2 이중억제제로 나뉜다. 전자는 Akt 활성화를 조절(억제)해 피드백 작용에 의해 Akt가 과활성화되는 것을 막는데 독특한 작용을 한다. 후자는 mTORC1, mTORC2에 대한 선택성의 감수성을 높여준다.
1세대 …시롤리무스 템시롤리무스 에베롤리무스 리다포롤리무스
1980년대 중반 장기이식 후 기본 면역억제제로 타크롤리무스(tacrolimus) 등 칼시뉴린억제제(calcineurin inhibitor)가 처방되면서 용혈성요독증성증후군(Hemolytic Uremic Syndrome, 溶血性尿毒性症候群) 등 신장 기능 악화나 신생 종양 발생으로 사망하는 환자들이 많아졌다. 그러던 중 기존 면역억제제 단점을 보완한 mTOR 억제제의 등장으로 장기이식 면역치료가 새로운 전환점을 맞았다.
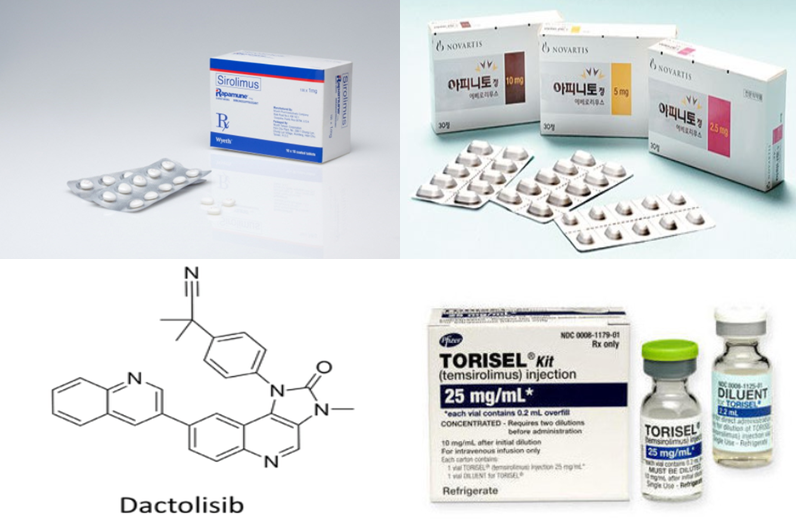
화이자 ‘라파뮨정’(Rapamune 성분명 시롤리무스, sirolimus)
mTOR 억제를 통해 인터루킨-2(interluekin-2) 민감도를 감소시켜 T세포와 B세포의 활성화를 억제한다. 시롤리무스는 장기이식을 받은 환자의 단기 생존율을 향상시켰다는 연구 결과에 따라 1999년 미국 식품의약국(FDA)에 승인을 받았다.
이후 13세 이상 신장이식 환자에서 발생하는 이식거부반응을 예방하기 위해 코르티코스테로이드와 사이클로스포린과 병용되고 있다. 13세 미만의 환자 또는 면역학적으로 위험이 높은 18세 미만의 신장이식 환자에 대한 안전성과 유효성 확립은 부족한 편이다. FDA는 2003년 동맥경화증(스텐트 이식 후 혈관협착증 포함), 2015년 림프관평활근종증(Lymphangioleiomyomatosis) 치료제로 추가 허가했다. 일관성 있게 식사와 함께 복용하거나 공복에 1일 1회 경구 복용한다. 부수거나 씹거나 잘라서 복용하지 않도록 해야 한다.
화이자 ‘토리셀주’(Torisel 성분명 템시롤리무스, temsirolimus)
시롤리무스 유도체(derivative)로 바이엘 ‘넥사바정’(성분명 sorafenib)과 화이자 ‘수텐캡슐’(성분명 sunitinib)에 이어 세 번째 신세포암 정맥주사제로 2007년에 FDA 승인을 받았다. G1 세포주기를 차단하며 혈관내피세포성장인자(Vascular endothelial growth factor, VEGF)의 합성을 감소시켜 신생혈관 발현을 억제한다. 주 1회 25mg을 30~60분에 걸쳐 점적 정맥 투여한다.
노바티스 ‘아피니토정’(Afinitor 성분명 에베롤리무스, everolimus)
에베롤리무스는 표적항암제로 쓰일 경우에는 아피니토정이 되고, 장기이식 후 면역거부반응 억제제로 쓰일 경우에는 써티칸정(Certican)으로 명명된다.
아피니토는 2009년에 시롤리무스 유도체인 수니티닙 또는 소라페닙으로 치료되지 않는 진행성 신장암 환자들의 1차 치료제로 FDA 승인을 받았다. 이후 진행성 췌장암, 진행성 유방암, 소아 희귀 뇌종양 등의 적응증을 추가로 승인받았다. 1일 1회 경구 복용하며 2.5mg, 5mg, 10mg이 있다.
아피니토는 아로마타제 저해제(노바티스 페마라정, 알보젠 아리미덱스정 등)에 불응성이면서 에스트로겐 수용체 양성 또는 상피세포성장인자(HER-2) 음성인 국소 진행성 또는 전이성 유방암이 있는 폐경 후 여성에서 화이자 아로마신정 (엑스메스탄)과 병용 투여할 수 있다.
또 췌장에서 기원한 진행성 신경내분비종양(pancreas neuroendocrine tumor, pNET) 1차 치료제로 승인받았다. 위장관 또는 폐 기원의 진행성(절제불가능한 국소 진행성 또는 전이성)의 고도로 분화된 비기능적 신경내분비종양 (GI/Lung NET)의 치료제다.
써티칸은 증식신호 억제제 계열의 면역억제제로 심장, 신장, 간 등의 이식에 모두 적응증을 가진 유일한 약물이다. 신장 및 심장 이식에서 사이클로스포린 및 코르티코스테로이드와 병용한다. 간 이식에서는 타크로리무스 및 코르티코스테로이드와 병용한다.
이밖에 미국 MSD와 아리아드파마(Ariad pharma)가 리다포롤리무스(Ridaforolimus 코드명 AP23573, MK-8669)라는 최신 라파마이신 유도체를 공동 개발 중이다. 일본 다케다는 아리아드파마를 2017년 52억달러를 들여 인수했다.
2세대 … 닥톨리십 복스탈리십 아피톨리십 세파니세르팁 비스투세르팁
2012년부터 연구가 시작됐으며 ATP 경쟁적 mTOR 인산화효소 억제제다. mTOR/PI3K 이중억제제인 노바티스 ‘닥톨리십’(dactolisib 코드명 NVPBEZ235, BEZ-235)은 항바이러스성, 항알레르기성 크림에 자주 사용되는 이미다조퀴놀린(imidazoquinoline)에서 파생된 신약후보물질로 PI3K와 mTOR를 억제한다. 국소진행 또는 전이성 HER2 음성 유방암과 췌장내분비종양(pancreatic neuroendocrine tumors, pNET)을 적응증으로 임상 2상을 완료했다. 항암제로서 아직 임상시험 중이다.
엑셀리시스 ‘복스탈리십’(voxtalisib 코드명 XL765)은 고형종양, 비소세포폐암(NSCLC), 악성 신경교종(glioma), 유방암 등을 적응증으로 개발 중이다. 제넨테크 ‘아피톨리십’(apitolisib 코드명 GDC0980)은 비호지킨림프종(non-Hodgkin’s lymphoma)을 대상으로 임상시험 중이며 닥톨리십과 마찬가지로 PI3K와 mTOR를 억제한다.
mTORC1/mTORC2 이중억제제로는 인텔리킨의 ‘세파니세르팁’(sepanisertib 코드명 INK128, TAK-228) 있다. 이 신약후보물질은 유방암, 자궁내막암, 교모세포종(glioblastoma), 신세포암(renal cell carcinoma), 갑상선암 등을 적응증으로 임상 2상 시험을 진행 중이다. 이밖에 아스트라제네카 ‘비스투세르팁’(vistusertib 코드명 AZD2014)이 고형종양을 목표로 한 mTORC1/mTORC2 이중억제제로 개발되고 있다.
mTOR억제제의 가장 흔한 부작용은 감각장애(peripheral edema), 고콜레스테롤혈증(hypercholesterolemia), 복통, 두통, 설사, 변비, 고혈압, 메스꺼움, 통증, 크레아티닌 증가, 요로감염, 빈혈 등이 있다.
mTOR억제제는 여러 암종에 적용될 수 있는 다양성을 갖고 있지만, 환자를 선별하고 치료경과를 추적평가할 바이오마커가 없는 게 한계다. mTOR 관련 바이오마커에 너무 예민하거나 저항성을 보여 선명하게 적합한 환자군을 추려낼 수 없는 게 결점으로 남아 있다.

