한국바이오의약품협회가 주요국의 의약품 신속심사 제도를 종합 분석한 ‘주요국의 의약품 신속심사 제도’ 보고서를 발간하며 글로벌 신약 허가 환경이 ‘속도 중심’으로 재편되고 있음을 짚었다.
미국을 비롯해 중국, 일본 등 주요국에서는 이미 신약 허가의 상당 비중이 신속심사 경로를 통해 이뤄지고 있으며, 한국 역시 신속허가 제도 고도화를 통해 글로벌 흐름에 발맞추고 있다는 해석이다.
협회는 미국, 유럽, 일본, 중국, 한국의 의약품 신속심사 제도 현황을 분석한 보고서를 발간했다고 22일 밝혔다. 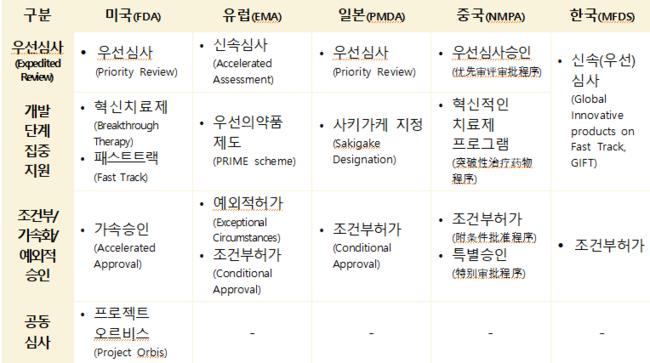
미국은 기존 우선심사(Priority Review), 혁신치료제(Breakthrough Therapy) 지정 외에도 더욱 세분화된 신속심사 제도를 도입하며 규제 유연성을 극대화하고 있다.
국가 우선 바우처(Commissioner’s National Priority Voucher, CNPV) 시범 프로그램 (2025년 6월 공식 발표): 미국의 공중보건 위기 해결이나 공급망 회복력 강화를 위한 의약품을 대상으로 하며, 완전한 신청서 검토 기간(심사기간)을 1~2개월까지 단축할 수 있는 혜택을 제공한다.
희귀질환 근거 원칙(Rare Disease Evidence Principles, RDEP, 2025년 9월 도입): 1000명 미만의 극희귀질환 치료제 개발 시, 소규모 환자 집단의 특성을 고려하여 유연한 근거 자료를 인정해 주는 절차다.
타당한 기전 경로(Plausible Mechanism Pathway, 2025년 11월 신설): 치료제의 질병 표적 가능성에 대한 합리적인 기전적 근거가 확보되면 허가를 검토하는 경로로, 도입된다면 맞춤형 치료제의 시장 진입을 더욱 앞당길 것으로 전망된다.
2024년 신약 승인 시 ‘우선심사’ 활용 비율이 가장 높았던 국가는 미국으로 나타났다. 미국의 활용률은 59%에 달하며, 중국(35%), 일본(34%)이 그 뒤를 이었다.
특히 미국은 ‘개발 단계 집중 지원’(Breakthrough Therapy, Fast Track) 항목에서도 64%의 높은 활용률을 기록했다. 신속심사 경로를 활용한 신약은 평균 심사기간이 6~9개월로, 표준심사(10~12개월) 대비 최대 6개월까지 단축되는 효과를 보였다. 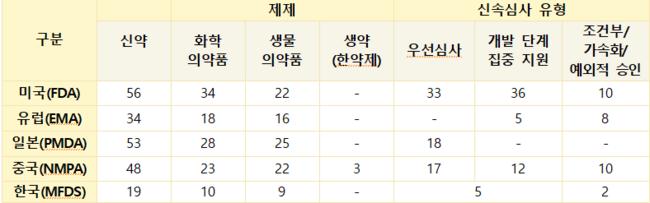 2024년 주요국의 신약 승인 현황 (유효성분 기준)한국의 경우, 2024년 승인된 신약 19건 중 5건이 GIFT(Global Innovative products on Fast Track) 허가심사를 통해 승인됐다. 2025년 9월까지의 통계에 따르면, GIFT 품목의 평균 심사 소요 기간은 70일(근무일 기준)로, 법정 처리 기한 대비 약 25%의 기간 단축 성과를 거두며 국내 신약의 신속한 시장 진입을 지원하고 있다.
2024년 주요국의 신약 승인 현황 (유효성분 기준)한국의 경우, 2024년 승인된 신약 19건 중 5건이 GIFT(Global Innovative products on Fast Track) 허가심사를 통해 승인됐다. 2025년 9월까지의 통계에 따르면, GIFT 품목의 평균 심사 소요 기간은 70일(근무일 기준)로, 법정 처리 기한 대비 약 25%의 기간 단축 성과를 거두며 국내 신약의 신속한 시장 진입을 지원하고 있다.
협회는 국내 기업이 해외 진출 시 의약품 개발 초기 단계(임상 1·2상)부터 미국 식품의약국(FDA), 유럽의약품청(EMA), 일본 의약품의료기기총합기구(Pharmaceuticals and Medical Devices Agency, PMDA) 등 현지 규제 당국과 사전 협의를 통해 신속심사 적격성을 타진해야 한다고 강조했다.
식약처가 2025년 12월 바이오의약품허가과를 정규조직으로 전환하고 심사 인력을 확충하는 등 허가 프로세스 개선을 추진하고 있는 만큼, 기업들은 정부의 밀착 지원을 활용하여 시장 진입 기간 단축을 도모할 필요가 있다고 언급했다.