식품의약품안전처는 사노피아벤티스코리아의 혈우병 A 치료제인 ‘알투비오주’(Altuviiio 성분명 에파네스옥토코그 알파, efanesoctocog alfa, Fc-VWF-XTEN Fusion Protein-ehtl)를 23일 허가했다.
이 약은 ‘성인 및 소아 혈우병 A 환자의 출혈 예방 및 관리’를 위한 치료제로 허가됐다. 구체적으로 △출혈 빈도 감소를 위한 일상적 예방요법 (Routine prophylaxis) △출혈 시 보충 요법(on-demand) 및 출혈 억제 △수술 전후 출혈의 관리 등을 위해 투여한다.
혈우병 A는 선천적으로 혈액응고8인자가 결핍되는 희귀혈액질환으로, 외상에 반응하여 생명을 위협하는 출혈과 연조직 및 관절에 재발성 출혈이 유발된다.
A형 혈우병에서 8번 응고인자 결핍으로 인한 반복적인 관절 및 근육 출혈은 장기적인 관절 손상과 삶의 질 저하로 이어질 수 있기 때문에, 예방요법을 통한 안정적인 혈액응고인자 활성도 유지가 필수적이다. 그러나 표준 반감기 제제(Standard Half-Life, SHL)와 반감기 연장 제제(Extended Half-Life, EHL)는 출혈 예방에서 충분한 활성도 유지가 어렵거나 잦은 투여로 인한 치료 부담이 커 안정적으로 출혈 예방 효과를 제공할 수 있는 새로운 치료 옵션에 대한 의학적 미충족 요구가 지속돼 왔다.
알투비오는 항혈우병인자 단백질 계열 최초의, 지속형 유전자재조합 제8혈액응고인자 제제다. 내인성 혈액응고8인자와 동일하게 제9인자와 복합체를 형성하여 제10인자를 활성형으로 전환시키고, 이어 프로트롬빈을 트롬빈으로 전환하여 피브린 응고 형성을 돕는다.
알투비오는 반감기 한계를 극복하기 위해 Fc 도메인, 폰 빌레브란트 인자(VWF) 비의존적 설계, XTEN 기술이 적용된 최초의(First-in-class) 장기 지속형 응고인자 제제(High Sustained Factor, HSF)이다. 알투비오는 이를 통해 주 3~4회 투여가 필요했던 기존 응고인자 제제 대비 주 1회 투여만으로 체내 혈액응고인자 활성도를 15% 이상 유지해 치료 안정성과 편의성을 획기적으로 개선함으로써, A형 혈우병 소아 및 성인 환자가 일상적인 삶을 누릴 수 있게 해주는 새로운 치료 기회를 제공할 것으로 기대되고 있다. 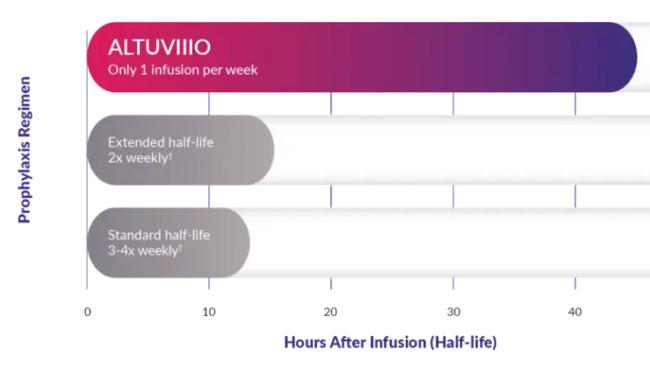
이 약은 기존 허가 의약품 대비 반감기를 연장한 주 1회 투여 가능한 지속형 정맥주사제형 치료제다. 기존 주2회, 또는 주3~4회 치료제의 반감기가 10시간 남짓인데 비해 알투비오는 40여시간에 달해 약 3~4배에 달한다. 주 1회 투여로 주중 대부분의 기간에 제8혈액응고인자의 활성도가 정상(혈장 1ml당 평균 50 IU/dL 이상)~준정상(40 IU/dL 이상)을 최초이자 유일한 A형 혈우병 치료제이다. 투여 7일째에는 15IU/dL선으로 떨어지긴 하나 이 정도만 돼도 출혈 위험을 상당 부분 낮출 수 있다. 여기서 IU/dL은 %와 같은 개념으로 사용된다.
이번 알투비오 허가는 기존 치료 경험이 있는 A형 혈우병 소아 및 성인 환자를 대상으로 진행된 글로벌 다기관 3상 임상시험 프로그램인 XTEND-1 및 XTEND-Kids 연구 결과를 근거로 이뤄졌다. 이들 연구에서 알투비오 투여군의 주 평균 혈액응고인자 활성도는 40 IU/dL 이상으로 정상 또는 준정상 범위를 4일 동안 유지했다. 성인 환자만을 대상으로 진행된 연구에서는 투여 7일차에도 15 IU/dL로 나타나 안정적인 출혈 예방 효과가 지속됨을 확인했다.
XTEND-1 연구에서 12세 이상 청소년 및 성인을 대상으로 알투비오 50 IU/kg으로 주 1회 예방요법을 시행한 결과, 연간 모든 출혈률·자발성 출혈률·관절 출혈률 중앙값이 모두 0.0으로 나타났으며, 알투비오 투여군은 기존 응고인자 제제로 예방요법을 시행한 환자군 대비 연간 출혈률(annualized bleeding rate, ABR)이 77% 유의하게 감소한 것으로 확인됐다.
12세 미만 소아를 대상으로 한 XTEND-Kids 연구에서도 예방요법의 효과는 일관되게 관찰됐다. 알투비오 50 IU/kg으로 주 1회 예방요법 시행 시 연간 모든 출혈률·자발성 출혈률·관절 출혈률의 중앙값이 모두 0.0으로 보고되며, 연령대에 관계없이 안정적인 출혈 예방 효과를 확인할 수 있었다.
알투비오는 출혈 시 보충요법에서도 12세 이상 환자 96.7%, 12세 미만 환자 95.3%가 출혈 에피소드 시 단회 투여로 해결되는 우수한 지혈 효과를 확인했다. 또 수술 전후 출혈 관리에서도 알투비오는 총 49건의 대수술 중 98%가 담당 의사 평가에서 ‘우수’ 또는 ‘양호’로 판단됐다. 32건의 경미한 수술 중에서는 평가가 이루어진 모든 사례에서 지혈 효과가 ‘우수’로 보고됐다.
이를 통해 알투비오는 A형 혈우병 소아 및 성인 환자에서의 일상적인 예방요법뿐 아니라, 실제 임상 현장의 모든 치료 상황에 대응 가능한 통합 치료 옵션으로서 치료 혜택을 입증했다.
안전성 프로파일 측면에서도 알투비오는 XTEND-1 및 XTEND-Kids 연구 모두에서 일관된 내약성을 확인했다. 이들 연구에서 보고된 이상반응은 대부분 경미한 수준이었으며, 약물과 연관된 중대한 이상반응으로 치료를 중단 사례나, 8번 응고인자 항체가 새롭게 발생한 사례는 없었다.
식약처는 알투비오를 2024년 8월 글로벌 혁신제품 신속심사 지원체계(GIFT) 대상으로 지정하고 빠르게 심사・허가했으며, 성인 및 소아 선천성 혈우병 A 환자의 치료 접근성이 확대될 것으로 기대된다고 밝혔다. 국내서는 2024년 5월 희귀의약품으로 지정됐다.
알투비오는 미국에서 2023년 2월 23일, 출혈 에피소드의 일상적인 예방, 출혈 조절을 위해 필요할 때 사용하는 치료, 청소년 및 성인 A형 혈우병 환자들의 수술 전‧후 관리 등의 적응증으로 시판허가를 받았다. 앞서 2022년 5월 미국 식품의약국(FDA) 혁신치료제로 지정된 바 있다.
알투비오는 프랑스 사노피가 스웨덴 제약기업 소비(Sobi, Swedish Orphan Biovitrum AB)와 공동 개발했다.
사노피는 자사의 오래된 ‘엘록테이트주’(Eloctate 성분명 에프모록토코그 알파 efmoroctocog alfa)의 시장을 로슈의 ‘헴리브라피하주사’(Hemlibra 성분명 에미시주맙, Emicizumab)가 잠식하기 전까지 호황을 누렸다. 헴리브라는 혈액응고 제8인자의 혈액응고 작용기전을 모방해 혈액응고 제9인자와 제10인자에 동시에 결합하는 이중항체 기술을 적용한 혁신신약이다. 이렇게 되면 혈액응고 캐스케이드(cascade)가 일어나 출혈반응을 멈출 수 있다. 주 1회부터 최대 4주당 1회 피하주사하는 헴리브라는 국내서 JW중외제약이 판매 중이다.
사노피가 이번 알투비오 허가를 통해 헴리브라의 공세를 막아내고 시장을 넓여갈지 주목된다.