 저항성 고혈압 최신 신약인 아이도시아의 ‘트리비오’ 스위스 바젤에 기반을 두고 미국 펜실베이니아주 동남부 도시 래드너(RADNOR)에서 활동 중인 아이도시아파마슈티컬스(Idorsia Pharmaceuticals) 미국 현지법인은 저항성 고혈압 치료제 ‘트리비오’(Tryvio 성분명 아프로시텐탄, aprocitentan)를 2024년 3월 20일, 미국 식품의약국(FDA)으로부터 승인받았다. 트리비오는 다른 약제들을 사용했을 때 혈압을 충분한 수준으로 조절할 수 없는 성인 고혈압 환자들에게서 혈압을 낮추기 위해 다른 항고혈압제들과 병용하는 용도로 허가됐다.
저항성 고혈압 최신 신약인 아이도시아의 ‘트리비오’ 스위스 바젤에 기반을 두고 미국 펜실베이니아주 동남부 도시 래드너(RADNOR)에서 활동 중인 아이도시아파마슈티컬스(Idorsia Pharmaceuticals) 미국 현지법인은 저항성 고혈압 치료제 ‘트리비오’(Tryvio 성분명 아프로시텐탄, aprocitentan)를 2024년 3월 20일, 미국 식품의약국(FDA)으로부터 승인받았다. 트리비오는 다른 약제들을 사용했을 때 혈압을 충분한 수준으로 조절할 수 없는 성인 고혈압 환자들에게서 혈압을 낮추기 위해 다른 항고혈압제들과 병용하는 용도로 허가됐다.
이중(二重) 엔도텔린수용체 길항제(endothelin receptor antagonist, ERA) 계열로 허가를 취득한 것은 트리비오가 최초다. 유럽에서는 ‘제라이고’(JERAYGO)라는 상품명으로 2024년 7월 1일 유럽위원회(EC)의 승인을 받았다.
참고로 아이도시아는 2017년 존슨앤드존슨이 악텔리온(Actelion Pharmaceuticals)을 인수하는 과정에서 별도로 분사돼 설립된 회사다. 존슨앤드존슨은 아이도시아의 개발 품목 중 1품목에 대한 판매 구매 옵션을 행사, 아프로시텐탄을 지목 판매 권리를 확보했다. 이후 양사는 2023년 합의에 따라 존슨앤드존슨이 아프로시텐탄의 판권을 아이도시아에 반환했으며 아이도시아가 FDA와 유럽 승인을 받게 됐다.
트리비오는 2007년에 FDA 승인을 받은 노바티스의 ‘라실레즈’(Rasilez, 성분명 알리스키렌, Aliskiren)와 그 복합제인 ‘엑스포지(Exforge, 성분명 알리스키렌+하이드로클로로치아자이드) 이후 17년 만에 등장한 고혈압 치료제다. 칼슘길항제(니페디핀 1981년, 베라파밀 및 딜티아젬 1982년 미국 승인) 이후 40여 년 만에 새로운 작용기전으로 허가받은 고혈압 약이기도 하다.
라실레즈의 경우 직접 레닌 억제제(direct renin inhibitor)로 작용시간이 길고 효과도 좋을 것이라 기대를 모았지만 그에 부응하지 못하는 유효성(심혈관질환 및 신장질환 환자에서 장기적 효과 미입증), 부작용(동아시아인에서 심한 기침 유발, 두통, 어지럼증, 설사 등), 높은 약가 대비 낮은 효율성 등을 이유로 국내서 허가가 난 지 6년 만인 2014년에 자진 퇴출됐다.
아프로시텐탄은 엔도텔린(ET-1)이 ETa 및 ETb 수용체에 결합하는 것을 강력하게 억제함으로써 혈압을 떨어뜨린다. 엔도텔린은 내피세포에서 생성되는 21개의 아미노산으로 이루어진 펩타이드로서, 혈압 상승에 관여하는 호르몬의 일종인 알도스테론의 생성을 촉진하는 주요한 인자의 하나로 알려져 있다. 엔도텔린은 강력한 혈관 수축제로 작용하며 때로는 암의 전이(예컨대 전립선암의 골 전이)에 관여하기도 한다.
기존 항고혈압제들은 나트륨과 수분량을 조절하는 데 초점이 맞춰진 이뇨제, 레닌-안지오텐신-알도스테론계(RAAS) 길항제, 세포 외부에서 세포 내부로 유입되는 칼슘의 양을 낮추는 칼슘채널 차단제, 베타교감신경의 활성화를 억제해 심근수축력과 심장박동수를 감소시키는 베타교감신경차단제, 혈관수축을 억제하는 알파차단제, 베타차단제 중 비 선택적 혈관확장제(carvedilol, bucindolol, labetalol 등) 등이 주종을 이뤄왔다.
트리비오의 권고용량은 식사와 병행하거나 병행하지 않으면서 12.5mg을 1일 1회 경구 복용하는 것이다.
아이도시아의 장-폴 클로젤(Jean-Paul Clozel) 대표는 트리비오 허가 당시 “수백만명의 미국민들이 기존 치료제들을 사용하고 있음에도 불구하고 혈압을 충분하게 조절하지 못하고 있다”며 “이는 심혈관계 및 뇌혈관계 여러 증상 위험성을 높이는 중요한 공공보건상 이슈의 하나”라고 말했다. 이어 “이런 이슈에 대응하는 것을 돕기 위해 아이도시아가 엔도텔린 수용체 길항제인 아프로시텐탄을 개발하게 됐다”고 설명했다.
클로젤 대표는 “아이도시아가 최소한 3개 치료제들을 최적 용량으로 사용했거나, 때로는 4~5개에서 최대 6개에 이르는 항고혈압제들을 사용했음에도 불구하고 고혈압 상태가 유지되고 있는 환자들을 대상으로 야심찬 임상개발 프로그램을 진행해왔다”며 “이제 조절이 어려운 고혈압 환자들을 위한 새로운 치료대안을 의사들에게 공급할 수 있게 된 것을 대단히 자랑스럽고 행복하다”고 덧붙였다.
트리비오는 고혈압 환자들을 대상으로 단독요법으로 이루어진 1건의 2상 임상시험, 저항성 고혈압을 진단받은 환자들을 위한 부가요법제로 사용한 1건의 3상 ‘PRECISION’ 임상시험을 통해 평가받았다. 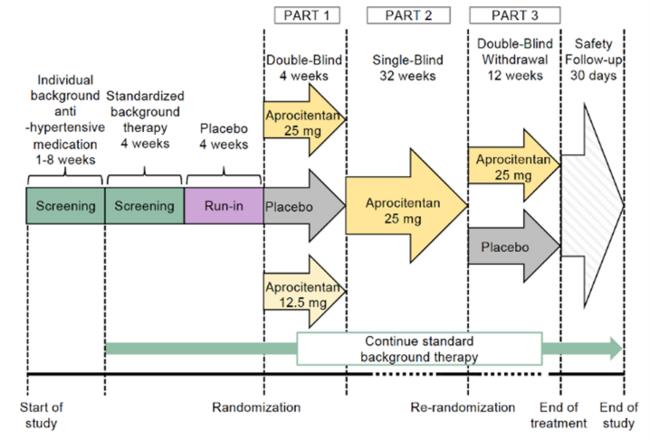 ‘트리비오’의 3상 PRECISION 임상시험 설계 구조
‘트리비오’의 3상 PRECISION 임상시험 설계 구조
PRECISION 임상에서 트리비오는 수축기혈압이 140mmHg 이상이고 적어도 3개의 고혈압약(이뇨제, 안지오텐신 수용체 차단제, 칼슘채널차단제 등 표준요법)을 복용한 사람을 대상으로 4주차(4주간의 표준요법 스크리닝 기간 완료 후)에 평가했을 때 위약 대조군 대비 양호한 내약성을 나타냈고 우위의 혈압강하 효과가 입증했다. 그 효과는 40주차까지 유지됐다.
이 임상에서 모든 피험자는 위약으로 4주간의 휴약기간(run-in period)를 거쳤다. 휴약기를 마친 후 730명의 환자는 4주간의 1차 이중맹검(DB) 치료 기간에 거의 같은 비율로 아프로시텐탄 12.5mg 또는 25mg 1일 1회 복용, 위약 1일 1회 복용 등 3가지 그룹으로 나뉘어 무작위 배정받았다(파트1).
이어 모든 환자는 단일맹검 치료 기간(파트2)에 들어가 32주 동안 1일 1회 아프로시텐탄 25mg을 투여받았다. 32주가 지난 후 환자들은 12주간의 2차 이중맹검(DB) 기간에 아프로시텐탄 25mg 또는 위약을 1일 1회 투여하도록 다시 무작위 배정됐다(파트3).
1차 유효성 평가지표는 파트1 완료 시점(치료 기저점 대비 4주차)에 앉은 자세에서 측정한 수축기혈압(sitting SBP, SiSBP, 착석 수축기혈압)의 변화였다. 이는 무인진료실자동측정혈압(unattended automated office blood pressure, uAOBP)으로 평가됐다.
주요 2차 평가지표는 36주차(4주+32주차 시점, 즉 파트3에서 아프로시텐탄 25mg 또는 위약을 배정받은 시점)와 40주차(배정받아 4주간 치료를 마친 시점)의 uAOBP를 통해 측정된 약물 복용이 혈압이 떨어지는 최저점(trough) 기준의 SiSBP의 변화였다.
환자의 평균 연령은 62세(24~84세)였으며 60%가 남성이었다. 인종별로는 백인(83%), 아프리카계 미국인(11%), 아시아인(5%)이었다. 약 10%가 히스패닉이었다.
평균 체질량지수(BMI)는 34kg/㎡ (범위 18~64kg/㎡)였다. 기준선(치료시작 시점)에서 환자의 19%는 추정 사구체여과율(eGFR)이 30~59mL/min/1.73㎡였고 3%는 eGFR 15~29mL/min/1.73㎡였다. 기준선에서 환자의 24%는 소변 알부민-크레아티닌 비율(UACR)이 30~300mg/g이었고, 13%는 UACR이 300mg/g 이상이었다. 환자의 약 54%는 당뇨병 병력이 있었고, 31%는 허혈성 심장질환, 20%는 울혈성 심부전을 앓고 있었다. 기준선에서 환자의 63%가 4개 이상의 항고혈압제를 복용하고 있는 것으로 보고됐다.
트리비오 12.5mg은 4주차(파트1)에 SiSBP를 감소시키는 데 있어서 위약보다 통계적으로 우수했다. 치료 효과는 앉은 자세에서 측정한 착석 이완기혈압(SiDBP)에서도 일관되게 나타났다.
트리비오의 혈압 강하 효과의 지속성은 파트3에서 입증됐다. 아프로시텐탄을 투여받은 환자는 모든 환자에게 25mg을 투여한(파트2) 이후 다시 위약 또는 아프로시텐탄 25mg으로 다시 무작위 배정한(파트3) 결과 위약으로 다시 무작위 배정된 환자에서는 평균 SiSBP가 증가한 반면 아프로시텐탄 25mg으로 다시 무작위 배정된 환자에서는 SiSBP에 대한 평균 효과(mean effect, 실험군과 대조군의 평균 치료효과의 차이가 유지됨)가 유지되었으며 40주차에 위약보다 통계적으로 우수했다. 치료 효과는 SiDBP에 대해 일관되게 나타났다.
환자 대부분의 혈압 강하 효과는 트리비오 치료 첫 2주 이내에 나타났다. 다만 트리비오는 25mg 용량으로 승인되지 않았다. 파트1의 기준선 대비 4주차까지 SiSBP 변화 정도를 1차 평가지표로 측정한 결과 25mg 아프로시텐탄 용량의 효능은 12.5mg 용량과 유사했기 때문이다.
트리비오의 혈압 강하 효과는 연령, 성별, 인종, BMI, eGFR, UACR, 당뇨병 병력으로 정의된 하위군과 혈압 측정 방식(uAOBP 및 보행혈압 측정 포함)에 상관없이 일관되게 나타났다.
PRECISION 연구의 4주간의 이중맹검 위약대조 치료 기간(파트1) 동안 트리비오에 대해 가장 자주 보고된 이상반응은 부종/체액정체 및 빈혈이었다. 이 기간 트리비오 투여 환자 중 0.8%가 과민반응(발진, 홍반, 알레르기 부종)을 경험한 반면, 위약 투여 환자에서는 보고된 바가 없었다. 1명의 환자는 아프로시텐탄 25mg을 투여하는 동안 입원이 필요한 알레르기성 피부염을 경험했다. 아프로시텐탄이나 그 부형제에 과민증이 있는 환자에게는 트리비오 투여가 금기다. 임신 중 트리비오 사용도 금기다.
혈압을 낮추면 치명적 및 비치명적 심혈관사건, 주로 뇌졸중과 심근경색의 위험이 줄어든다. 이러한 이점은 다양한 계열의 항고혈압제에 대한 대조군에서 일관되게 나타난다. 다만 트리비오는 이런 효과를 입증한 대조군 시험이 이뤄지지 않았다.
아이도시아의 마르틴 클로젤(Martine Clozel) 최고과학책임자는 “일찍이 우리는 엔도텔린이 다른 항고혈압제들을 사용했음에도 불구하고 여전히 혈압 조절이 어려운 환자들에게 관여한다는 사실을 인식했다”면서 “이 같은 환자들에게서 엔도텔린 작용경로를 억제하려는 시도가 부재한 상황에서 우리는 이상적인 효과를 나타낼 수 있는 약제로 엔도텔린 수용체 길항제인 아프로시텐탄을 선택했다”고 말했다. 이어 “다양한 항고혈압제들을 사용했음에도 불구하고 혈압을 충분하게 조절하지 못한 환자들에게서 트리비오가 보여준 가 나타낸 효능 및 안전성 자료를 접하고서 고무됐다”고 회고했다.
PRECISION 임상에 참여한 뉴욕주립대 마이클 웨버(Michael A. Weber) 심혈관내과 교수는 그는 “트리비오를 처방받은 다른 약물들과 병용해 1일 1회 경구복용하면 조절할 수 없는 고혈압 부담을 감수하고 있는 환자들에게서 약물 상호작용 위험이 없는 대안이 될 것”이라며 “트리비오는 의사들이 간편하게 처방할 수 있고, 환자들도 간편하게 복용할 수 있는 항고혈압제”라고 소개했다.
알도스테론 합성 효소 억제제
알도스테론 합성효소 억제제(aldosterone synthase inhibitor, ASI)로서 엔도텔린 수용체 길항제의 대항마로 나선 두 가지 물질로 박스드로스타트(Baxdrostat)와 로룬드로스타트(lorundrostat)가 있다.
두 약물 모두 알도스테론 생성에 필수적인 효소인 알도스테론 합성효소를 억제하는 작용을 한다. 알도스테론은 저항성 고혈압에 상당한 영향을 주는 호르몬으로 알려져 있다. 박스드로스타트는 3상 ‘BrigHTN’, 로룬드로스타트는 2상 ‘Advance-HTN’ 및 3상 ‘Launch-HTN’ 임상연구에서 평가 중이다.
아스트라제네카가 개발 중인 박스드로스타트는 현재 고혈압 및 원발성 알도스테론증에 대한 단독요법으로, 만성 신장질환 및 고위험 고혈압 환자의 심부전 예방을 위해 다파글리플로진과 병용요법으로 임상시험이 진행 중이다. 코르티솔에 영향을 미치지 않으면서 알도스테론 수치를 효과적으로 감소시키는 것으로 그동안의 임상시험에서 확인됐다.
박스드로스타트는 BrigHTN 3상에서 두 가지 용량(2mg 및 1mg)이 12주차에 1차 평가지표인 평균 착석 수축기혈압(SiSBP)을 통계적으로 유의미하고 임상적으로 의미 있게 감소시켰다. 이 임상의 또 다른 1차 평가지표는 24~32주차의 효과 지속성, 52주차의 장기적 안전성이다.
이 임상시험은 또한 모든 2차 평가지표를 성공적으로 충족했다. 저항성 고혈압 ‘하위집단’에서 12주차의 착석 수축기혈압 감소, 12주차의 착석 이완기혈압 (SiDBP) 감소, 12주차에 착석 수축기 혈압을 130mmHg 미만으로 달성한 비율 등을 모두 만족했다. 박드로스타트는 전반적으로 내약성이 우수했으며 안전성 프로파일도 양호했다.
자세한 통계적 임상지표는 2025년 8월에 열리는 유럽심장학회(ESC) 학술대회 긴급 핫라인 세션에서 발표될 예정이다.
런던대학교 의학과 의장이자 주 연구자인 브라이언 윌리엄스(Bryan Williams) 박사는 “매우 유망한 BaxHTN 3상 결과는 표준치료에 더해 1일 1회 복용하는 박드로스타트가 수축기 혈압을 유의미하게 낮출 수 있으며, 심혈관질환의 주요 위험 요인인 고혈압을 조절하는 새로운 치료법을 제시할 수 있음을 보여준다”고 말했다.
아스트라제네카의 바이오제약 R&D 부문 샤론 바(Sharon Barr) 부사장은 “수축기 혈압을 통계적으로 유의미하고 임상적으로 유의미하게 감소시킨 BaxHTN 3상 임상 결과에 매우 만족한다”며 “이번 연구 결과는 박스드로스타트가 알도스테론 조절 장애를 표적으로 삼아 충족되지 못한 중요한 니즈를 해결할 수 있는 잠재력을 보여주는 강력한 증거이며, 20년 넘게 혁신이 거의 없었던 분야에 새로운 기전을 제시한다”고 강조했다.
로룬드로스타트는 2025년 3월, 3상 임상시험에서 임상적으로 유의미한 혈압 감소 효과를 입증했다. 미네랄리스테라퓨틱스(Mineralys Therapeutics)는 미쓰비시다나베파마로부터 로룬드로스타트의 판권을 확보, 임상 개발을 진행 중이다.
미네랄리스테라퓨틱스는 3월 10일, Launch-HTN 3상(NCT06153693)과 Advance-HTN 2상(NCT05769608)에서 로룬드로스타트 투약군이 위약군 대비 통계적으로 유의미하고 임상적으로 의미 있는 혈압 감소 효과를 보였다고 밝혔다.
3상은 기존 고혈압 치료제 2~5가지를 복용해도 혈압이 조절되지 않은 성인 1083명을 대상으로 진행됐다. 50mg 용량을 투약군의 6주차 수축기혈압은 16.9mmHg 감소했고, 위약에 비해 9.1mmHg 만큼 더 혈압을 낮췄다. 12주차에는 19.0mmHg 감소함으로써 효과가 더 강화됐고 위약 대비 11.7mmHg 가량 혈압을 더 떨어뜨렸다.
2상은 기존 2~3가지 고혈압 치료제를 투약받은 환자 대상으로 진행됐으며 12주 차에서 24시간 평균 수축기 혈압이 위약 대비 7.9mmHg 더 감소했다.
안전성 프로파일은 우수한 것으로 평가됐다. 전체적으로 심각한 이상반응은 드물었으며, 고칼륨혈증 발생률도 기존 연구와 유사한 수준이었다. 자세한 데이터는 2025년 3월 29일 미국심장학회(ACC)에서 공개됐다.
미네랄리스의 존 콩글턴(Jon Congleton) 대표는 “임상의 긍정적인 결과는 로룬드로스타트가 미국 내 1500만~2000만 명의 조절되지 않는 고혈압과 저항성 고혈압 환자들에게 새로운 치료 옵션이 될 가능성을 확인했다”며 “임상적으로 의미 있는 혈압 감소 및 안전성을 입증한 만큼, 승인 가능성이 높고 상업적 가치도 크다”고 밝혔다.
미네랄리스는 추가적인 장기 안전성 및 효과 데이터를 확보하기 위해 개방형 연장 연구(Transform-HTN)를 진행 중이다.
영국 바츠 헬스 NHS 트러스트(Barts Health NHS Trust)의 만니쉬 삭세나(Manish Saxena) 박사는 “로룬드로스타트 3상 연구는 최근 고혈압 치료제 연구 중 가장 규모가 큰 임상 중 하나로, 혈압 강하 효과와 안전성을 명확히 보여줬다”며 “조절되지 않는 고혈압과 저항성 고혈압은 심근경색, 뇌졸중 등 심혈관 사망의 주요 원인으로, 로룬드로스타트가 수백만 명의 환자들에게 효과적인 치료 옵션이 될 수 있다”고 평가했다.
로룬드로스타트는 고혈압, 만성콩팥병(CKD), 폐쇄성수면무호흡(OSA) 등 알도스테론 조절 이상과 관련된 질환 치료를 목표로 개발된 경구용 선택적 알도스테론 합성 억제제(aldosterone synthase inhibitor)로 CYP11B2 효소를 억제해 알도스테론 생성을 감소시키는 기전이다.
알도스테론 과분비는 고혈압 환자의 약 30%에서 관찰되며, 특히 기존 치료제에 반응하지 않는 환자군에서 중요한 치료 표적으로 여겨지고 있다.
참고로 미네랄리스는 일본계 벤처캐피털 카탈리스퍼시픽(Catalys Pacific)의 투자를 받아 2020년 설립됐다. 2021년 미쓰비시다나베파마로부터 로룬드로스타트(개발명 MT-4129, 이후 MLS-101) 판권을 확보, 개발을 진행해 왔다.
저항성 고혈압 치료를 위한 중재적 의료기기
인체의 혈압 조절 기전을 조절하거나 고혈압의 근본 원인을 직접 해소하는 것을 목표로 하는 의료기기 기반의 중재적 치료법이 시도되고 있다.
그 방법으로는 신장신경 차단술(renal denervation, RDN), 기압반사 활성화치료(baroreflex activation therapy), 경동맥소체 절제술(carotid body ablation, 주로 고주파 소작술), 동정맥 우회로 연결술(arteriovenous shunts), 뇌심부자극술(deep brain stimulation) 등이 있다.
이 중 신장신경 차단술은 저항성 고혈압에 대해 가장 많이 연구되고 유일하게 FDA가 승인한 중재적 의료기기 기반 치료법이다. 레코르메디칼(ReCor Medical)의 ‘Paradise Ultrasound Renal Denervation system’과 메드트로닉의 ‘Symplicity Spyral Renal Denervation System’ 등 두 가지 제품이 2023년 11월에 각각 1호, 2호 제품으로 승인됐다.
두 제품 모두 신장동맥을 둘러싼 교감신경을 표적으로 삼아 교감신경을 차단한다. 하지만 방법은 달라서 파라다이스 시스템은 초음파를 사용하는 반면 심플리시티 스파이럴 시스템은 고주파 절제술을 채택한다.
RDN은 표준치료가 아닌 보조요법으로 간주된다. 즉 생활습관 개선 및 약물요법과 병용하되 이를 대체할 수는 없다. 환자는 RDN을 고려하기 전에 저항성 고혈압의 다른 잠재적인 원인이 있는지 면밀히 평가받은 다음에 사용할 수 있다. 비용 대비 효율성은 떨어지고 장기적 효과도 미흡한 단점을 고려해야 한다.
신장신경차단술은 대조군에 비해 진료실 수축기 혈압을 평균 4~6mmHg 더 낮추며, 약물치료에 보조적인 요법으로 제안될 수 있다. 연구에 따르면 이 시술은 수축기 혈압과 이완기 혈압을 모두 감소시킬 수 있지만 그 정도는 크지 않다. 일부 환자는 유의미하고 지속적인 감소를 경험하지만 편차가 있다. 신장신경 차단술에 대한 치료반응은 개인차가 커서 모든 환자가 비슷한 수준의 효과를 경험하는 것은 아니다.
국내서는 한독 계열사인 칼로스메디칼의 고혈압 치료를 위한 ‘범용전기수술기 및 일회용 발조절식 전기수술기용 전극’(제품명 디넥스, Denex)이 2023년 6월 21일, 식품의약품안전처로부터 제34호 혁신의료기기로 받았다. 혁신성은 인정되지만 효과가 명료하게 입증되지 않은 만큼 아직 정식 승인은 나오지 않았다.
디넥스는 약물치료로 고혈압이 조절되지 않는 환자에 대해 고주파 에너지를 이용해 치료하는 국내 첫 제품이다. 전극 카테터를 신장동맥에 삽입해 목표 부위에 고주파 에너지를 전달함으로써 혈관 외벽에 분포한 교감신경을 차단함으로써 고혈압을 치료한다.

