한국얀센의 ‘다잘렉스피하주’((성분명 다라투무맙)와 한국로슈의 ‘폴라이비주’(폴라투주맙베도틴)가 식품의약품안전처 허가를 받은 지 5년 만에 건강보험 급여 등재를 위한 암질환심의위원회를 통과했다.
PD-L1 억제제 계열의 한국로슈 면역관문억제제 ‘티쎈트릭주’(아테졸리주맙)와 한국릴리의 CDK4/6 억제제 ‘버제니오주’(아베마시클립)는 각각 조기 폐암과 유방암 환자의 수술후 보조요법으로 급여 여부를 심의받았지만 희비가 갈렸다. 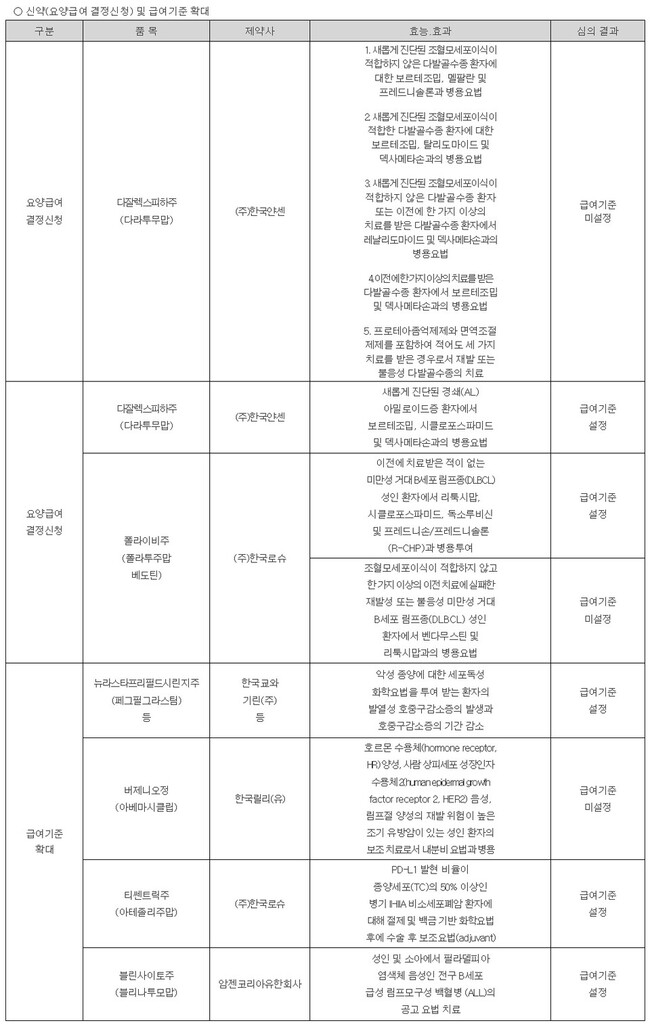
건강보험심사평가원은 지난 23일 암질환심의위원회(암질심)를 열고 다잘렉스피하주(다잘렉스SC)와 폴라이비의 일부 적응증에 대한 급여 기준을 인정했다.
2020년 6월과 10월 각각 식약처로부터 허가 받은 다잘렉스피하주사(다잘렉스SC)와 '폴라이비는 5년이 지나서야 처음으로 암질심 문턱을 넘어섰지만 반쪽짜리 통과였다.
다잘렉스SC는 기존 정맥주사제였던 CD38 항체 ‘다잘렉스’의 투약 편의성을 높이기 위해 개발된 피하주사제다. 한국얀센은 현재 정맥주사제가 급여를 받고 있는 다발성골수종 관련 5개 적응증(DVMP, DVTd, DRd, DVd 병용요법 및 단독요법)에 더해, 다잘렉스SC만이 보유한 ‘경쇄(AL) 아밀로이드증’ 치료 적응증에 대해서도 급여 신설을 신청했다.
그러나 암질심은 이들 6개 적응증 가운데 ‘새롭게 진단된 경쇄(AL) 아밀로이드증 환자에서 보르테조밉, 시클로포스파미드, 덱사메타손과의 병용요법’에 대해서만 급여 기준을 인정했다.
한국로슈도 폴라이비의 미만성 거대 B세포 림프종(DLBCL) 치료 적응증인 두 가지 병용요법(Pola-R-CHP, Pola-BR)에 대해 모두 급여를 신청했으나, 암질심은 ‘이전에 치료받은 적이 없는 DLBCL 성인 환자에서 리툭시맙, 시클로포스파미드, 독소루비신, 프레드니손/프레드니솔론과의 병용요법’(Pola-R-CHP)에 대해서만 급여 기준을 인정했다. 그러나 ‘재발성·불응성 DLBCL 환자에서 벤다무스틴·리툭시맙 병용요법’(Pola-BR)은 급여기준이 미설정됐다.
한국로슈의 티쎈트릭은 초기 비소세포폐암 환자에서 수술 후 보조요법으로 급여 기준을 인정받은 첫 항 PD-(L)1 면역항암제가 됐다. 급여 기준은 'PD-L1 발현 비율이 종양세포(TC)의 50% 이상인 2~3A기 비소세포폐암 환자에 대해, 절제술 및 백금 기반 화학요법 이후 시행하는 보조요법(adjuvant)‘으로 설정됐다.
한국릴리의 버제니오는 이번에도 무산됐다. 버제니오는 유방암 중 가장 흔한 아형인 호르몬 수용체 양성(HR+/HER2-) 환자 가운데 림프절 양성 등 재발 위험이 높은 환자를 대상으로 수술 후 보조요법에 사용 가능한 유일한 CDK4/6 억제제다. 하지만 관련 학회의 반복적인 요구에도 급여 등재에는 실패했다.
다만 최근 개정된 항암제 병용요법 급여 원칙에 따라 버제니오와 병용하는 내분비요법 치료는 기존과 동일하게 부분급여(5/100)가 인정되며, 버제니오는 전액 환자 본인 부담으로 사용할 수 있다.
암젠코리아의 ‘블린사이토주’(블리나투모맙)'와 한국쿄와기린의 호중구감소증 치료 성분제 ‘뉴라스타프리필드시린지주’ 등을 포함한 페그필그라스팀 함유 제제의 급여 확대 안건은 암질심을 통과했다.
블린사이토는 ‘성인 및 소아에서 필라델피아 염색체 음성인 전구 B세포 급성 림프모구성 백혈병 (ALL)의 공고요법’에, 페그필그라스팀 성분 제제는 ‘악성 종양에 대한 세포독성화학요법을 투여 받는 환자의 발열성 호중구감소증의 발생과 호중구감소증의 기간 감소’ 치료에 급여 기준이 설정됐다.

