 아스트라제네카의 임핀지(더발루맙)가 비소세포폐암 환자의 수술 전후 보조요법으로 FDA 승인을 받았다.
아스트라제네카의 임핀지(더발루맙)가 비소세포폐암 환자의 수술 전후 보조요법으로 FDA 승인을 받았다.
아스트라제네카는 16일 절제 가능한 초기 단계(2A기~3B기) 비소세포폐암(NSCLC) 환자의 수술 전 임핀지와 화학요법 병용 및 수술 후 임핀지 단독 요법으로 FDA 승인을 받았다고 발표했다. 단, EGFR 변이와 ALK 재배열이 없는 환자에 한해 투약이 승인됐다.
승인은 무사건 생존기간(EFS)의 개선을 보여준 AEGEAN 3상이 기반이 됐다. 화학요법 대비 임핀지 투약군은 질병의 재발, 진행, 사망의 위험을 32% 낮췄다(EFS 위험비: 0.68; 95% 신뢰구간: 0.53-0.88; p=0.003902).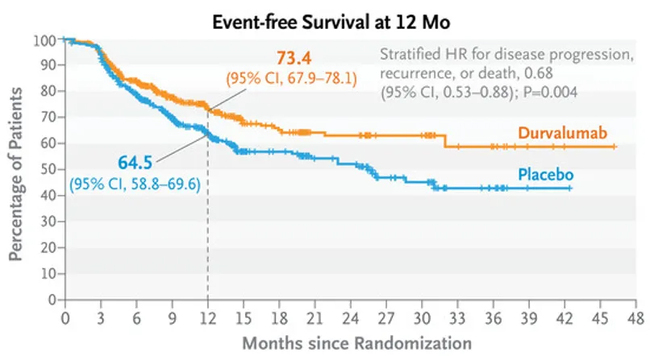
병리학적인 완전 반응(pCR)은 수술 전 임핀지와 화학요법을 병행한 경우 17.2%로, 화학요법 단독군 4.3% 대비 높았다.
텍사스 MD 앤더슨 암센터의 존 V. 헤이마크(John V. Heymach) 교수는 “이번 승인은 절제 가능한 비소세포폐암 환자에게 중요한 새로운 치료 옵션을 제공하며, 임핀지는 역사적으로 수술과 화학요법 후에도 재발율이 높은 이 환자들에서 중요한 치료 기반이 될 것”이라고 말했다.
아스트라제네카의 데이브 프레드릭슨(Dave Fredrickson) 부사장은 “이번 승인으로 임핀지는 절제할 수 없는 III기 질환의 치료 패러다임을 바꾸었으며, 이를 통해 초기 폐암에서 치료 목표인 완치를 향한 중요한 진전을 이뤘다”며 승인의 의미를 강조했다.

