동아에스티와 자회사 뉴로보파마슈티컬스(NeuroBo Pharmaceuticals)는 오는 6월 5일부터 8일까지 이탈리아 밀라노에서 개최되는 ‘EASL Congress 2024'(European Association for the Study of the Liver, 유럽간학회)에서 ‘MASH'(Metabolic dysfunction-associated steatohepatitis, 대사이상 관련 지방간염) 치료제 ‘DA-1241’의 전임상 연구 결과를 포스터로 발표한다고 24일 밝혔다.
DA-1241은 GPR119를 활성화시키는 계열 첫(Fist-in-Class) 합성신약으로서 1일 1회 경구복용이 가능하다. 동물실험 결과 혈당 및 지질개선 작용과 더불어 간에 직접 작용해서 염증 및 섬유화를 개선하는 효과가 확인돼 MASH 적응증으로 임상 2상 개발 중이다.
동아에스티와 뉴로보파마슈티컬스는 이번 학회에서 DA-1241과 GLP-1 receptor agonist인 세마글루타이드(Semaglutide)의 병용요법으로 MASH의 병인과 질병의 진행 정도가 다른 두 가지 마우스모델에서 확인한 비임상 유효성 결과를 2건의 포스터로 발표한다.
대사이상이 있는 식이 유발 MASH 마우스 모델에서 8주간 DA-1241과 세마글루타이드를 함께 투여받은 마우스는 모두 NAS(NAFLD Activity score, 지방간 활성도 점수)가 1점 이상 개선됐으며, 80% 이상의 개체에서 2점 이상의 개선효과를 보이는 우수한 약효를 나타냈다.
이는 세마글루타이드에 의한 체중 감소 효과에 DA-1241의 대사 개선 및 항염증 효과가 더해진 결과로 해석될 수 있다. 또 간 조직 유전체 분석을 통해 염증 및 섬유화와 관련된 유전자들의 발현 역시 두 약물의 병용에 의해 더욱 개선됨을 확인했다.
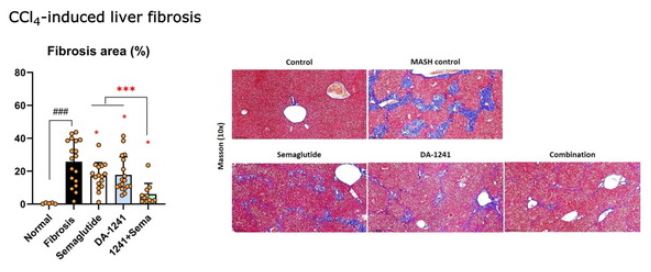 EASL 2024에서 발표된 DA-1241, 세마글루타이드 단독 및 병용요법의 간 섬유화 개선 효과
EASL 2024에서 발표된 DA-1241, 세마글루타이드 단독 및 병용요법의 간 섬유화 개선 효과
DA-1241과 세마글루타이드에 의한 병용효과는 간 섬유화 동물모델에서도 입증됐다. 간 섬유화 마우스 모델에서 DA-1241은 체중 감소를 유도하지 않았음에도 유의적으로 간 섬유화를 개선시켰으며, 체중감소를 유도하는 세마글루타이드와 병용 시에는 추가적인 체중 변화는 없었지만 각 약물의 단독 대비 통계적으로 유의한 섬유화 개선 병용효과를 나타냈다.
이런 병용 효과는 마우스 간 조직에서 분석된 염증 및 섬유화 관련 유전자들의 발현 변화에서도 나타났다. 특히 간 섬유화 마우스에서 감소돼 있던 섬유화 억제인자의 발현이 DA-1241과 세마글루타이드 병용에 의해 유의적으로 증가했다.
사람의 간 성상세포에 DA-1241을 단독 처리한 경우에도 섬유화 억제인자의 발현이 증가하고, 간 성상세포 활성 억제를 통해 간에 작용하여 섬유화를 억제하는 DA-1241의 주요 작용기전을 제시했다.
DA-1241은 글로벌 임상 2상 파트1, 파트2가 진행되고 있으며, 올해 하반기에 종료될 예정이다.
김형헌 뉴로보파마슈티컬스 대표는 “이번 데이터는 DA-1241 과 세마글루타이드 병용 시 간 섬유화 및 염증 상승 억제 효과에 대한 GPR119 와 GLP-1 기반 약물의 병용 개발 가능성을 입증했다”며 “DA-1241의 글로벌 임상 2상 결과를 올해 말에 발표할 수 있도록 최선을 다하겠다”고 말했다.
 리가켐바이오사이언스 로고
리가켐바이오사이언스 로고
리가켐바이오사이언스는 미국임상종양학회(ASCO) 2024에서 중국 파트너사인 포순제약이 FS-1502(LCB14, HER2 ADC)의 국소 진행성 또는 전이성 위암 또는 위식도접합부 선암 임상 2상 중간결과 초록을 공개했다고 24일 밝혔다.
LCB14는 HER2 양성 환자 대상으로 2.3mg/kg 용량에서 3주 1회 투여가 이뤄졌다, 임상 2상은 2개의 코호트(Cohort)로 구성됐다. 코호트1은 과거 2차 치료제 이상을 투약 받은 환자, 코호트2는 과거 1차 치료제만 투약 받은 환자를 대상으로 진행됐다.
LCB14의 유효성 결과는 코호트 1(16명)은 객관적반응률(ORR) 37.5%, 무진행생존기간 중앙값(mPFS) 4.3개월, 전체생존기간(OS) 10개월이다. 이는 유사한 환자군으로 진행된 다이이찌산쿄 '엔허투주'(성분명 trastuzumab Deruxtecan, 개발코드명 DS-8201a)의 DESTINY-Gastric06 임상결과인 ORR 35.6%, mPFS 5.7개월, OS 10.2개월과 유사한 수준이다.
코호트2(19명)의 유효성 결과는 ORR 52.6%, mPFS 4.4개월, 반응유지기간(DOR) 8.31%, OS 14.6개월이다. 이는 유사 환자군으로 진행한 엔허투의 DESTINY-Gastric02는 ORR 42%, mPFS 5.6개월, DOR 8.1%, OS 12.1개월로, mPFS를 제외한 대부분 효능지표에서 LCB14가 엔허투보다 효능지표가 우수한 것으로 확인됐다.
mPFS의 경우 투여 기간이 엔허투 대비 짧아(LCB14의 투여 최장기간 171일, 엔허투의 경우 각각 303일, 435일로 긴 치료기간) PFS가 미성숙 단계에 있다. LCB14는 현재 약물 부작용으로 인해 치료를 중단한 환자가 없으므로, 치료가 지속됨에 따라 mPFS는 공개된 초록 대비 높아질 것으로 예상한다.
LCB14는 부작용 지표에서 매우 우수한 결과를 보이고 있다. 전체 치료의향 임상환자(ITT, 46명)를 대상으로 3등급 이상 부작용은 12명(26.1%)에서 나타났다. 이 중 저칼륨혈증 (6.5%), 피로감(6.5%)이 주된 부작용이다. 약물 부작용으로 인한 투여 중단 또는 사망한 환자는 없었다.
반면 엔허투의 경우, 3등급 이상 부작용은 56%(79명 중 44명)이며 19%(15명)는 약물 부작용으로 치료를 중단했다. 또 2명의 환자는 약물연관 간질성 폐질환과 폐렴으로 사망했다.
LCB14는 최근 글로벌 ADC 항암제 시장을 빠르게 점유하고 있는 엔허투의 대체 가능한 약물로서 주목받고 있다. LCB14는 차별적으로 대다수 HER2 ADC 경쟁약물이 페이로드로 엑사테칸(exatecan) 계열 약물(즉 데룩스테칸)을 사용한 것과 달리 MMAF(monomethyl auristatin F)를 접합했다.
LCB14는 향후 엑사테칸 기인 약물 내성으로 재발한 환자 시장 및 엔허투 약물 부작용을 겪는 환자 시장을 공략할 수 있을 것으로 예상된다.
LCB14는 지난해 ASCO에서 유방암 임상 1상 중간 결과에서 엔허투 대비 유사 효능 및 우수한 안정성으로 주목받았다. 올해 ASCO에서 공개한 위암 임상 2상 결과를 통해 유방암 이어 위암에서도 경쟁약물 대비 뛰어난 치료 효과를 일관성있게 입증했다.
나아가 LCB14는 HER2 양성 유방암 환자 대상으로 '캐싸일라주'(성분명 trastuzumab emtansine)와 비교하는 3상을 비롯해 여러 고형암 대상 2상을 중국에서 진행하고 있다.
리가켐바이오 中 파트너사 시스톤(CStone), CS5001 첫 1a상 임상 데이터 ASCO 공개
리가켐바이오사이언스는 중국 쑤저우의 파트너사 시스톤(CStone Pharmaceuticals)이 24일 진행성 고형암 및 림프종 환자를 대상으로 한 ‘CS5001’(항 ROR1 항체약물결합체·ADC, 리가켐 개발코드명 LCB71) 임상 1a/1b 초기 임상 데이터가 포함된 초록을 ASCO(미국임상종양학회) 웹사이트에 공개했다고 밝혔다.
CS5001은 CStone Pipeline 2.0 주요 프로그램중 하나로, 리가켐이 독자 개발한 종양 특이적 절단 가능 링커와 pyrrolobenzodiazepine (PBD) 전구약물을 적용한 치료제로, 계열 첫 항ROR1(receptor tyrosine kinase-like orphan receptor 1) 표적 항체약물결합체(ADC)다. PBD 프로드럭은 혈중에서 조기 방출 시 비활성화 상태를 유지하고, 암세포에서만 활성화되는 독자 기술 플랫폼으로 일명‘톡신 플랫폼’이라고 한다.
CS5001은 한국의 리가켐과 ABL바이오가 공동 개발했고, 2020년 10월 시스톤이 한국 외 글로벌 개발 및 상업화에 대한 독점적 권리를 획득했다.
이번 연구는 진행성 고형암 및 B세포 림프종 환자를 대상으로 CS5001 안전성, 약동학(PK) 및 항종양 활성 등을 평가했다.
초록에 기재된 데이터 마감일 기준으로, 1a상 처음 8개 용량군(7~125μg/kg)에서 용량 제한 독성(DLT) 및 최대 허용 용량(MTD)가 관찰되지 않아 우수한 안전성을 보였고, 예상한 약동학적(PK) 특성을 나타냈다. 또, 미만성 거대B세포림프종(DLBCL), 호지킨 림프종, 비소세포폐암 (NSCLC), 췌장암 등을 포함한 다양한 고형암 및 혈액암에서 약효가 관찰됐다.
또 포스터에 명시된 데이터 마감일 기준, 용량군을 9단계(156μg/kg)까지 증량했음에도 DLT가 관찰되지 않았고, MTD에도 도달하지 않았다. 대부분의 약물 관련 이상반응은 1등급 또는 2등급(NCI-CTCAE v5.0기준)으로, 사전에 고도로 치료받은 진행성 고형암 및 림프종 환자들에게 CS5001이 우수한 안전성을 보였다.
CS5001의 PK 데이터 노출은 용량에 비례적이며, ADC와 전체 항체 노출도 유사해 CS5001약물이 체내 혈액 내 안정함을 입증했고, 다양한 고형암(RECIST v1.1 기준) 및 혈액 악성종양(Lugano 2014 기준)에서 고무적인 항종양 활성도 관찰됐다.
이와 함께 용량 수준 5~9에서 평가 가능한 9명의 환자 9명 중 완전반응(CR) 1명과 부분반응(PR) 4명이 관찰돼 객관적반응률(ORR) 55.6%를 달성했다.
고형암에서는 용량 수준 7(100μg/kg) 이상에서 다수 부분반응(PR) 및 안정 질병(SD)이 관찰됐으며, 특히 NSCLC(PR 1명, SD 3명), 췌장암(PR 1명), 삼중음성유방암(TNBC, SD 1명), 난소암(SD 1명)에서 이런 경향이 두드러졌다.
시스톤은 “현재 보고된 연구에서 1a상 용량 증량은 진행 중이며, 더 높은 용량에서 추가로 환자를 모집해 2상 권장 용량(RP2D)을 결정하고 ROR1 발현과 효능 간 관계를 평가할 예정”이라며 “ 업데이트된 데이터는 향후 투자자 미팅 및 학회(ESMO, ASH 둥)에서 공개될 예정이고, 용량 최적화 및 승인 가능성이 있는 잠재적 적응증에서 1b상 용량 확장 연구를 곧 시작하고 2024년 말까지 중추적 임상시험(승인을 위한 2상 또는 3상)을 시작할 계획”이라고 밝혔다.
EASL 2024에서 발표된 DA-1241, 세마글루타이드 단독 및 병용요법의 간 섬유화 개선 효과
리가켐바이오사이언스 로고

