아베종양내과 아베 이사장 “같은 암종이라도 환자별로 표면 항원 종류 다양”
전이·재발된 난소암·폐암·췌장암·유방암·대장암 등에서 ‘항암면역치료’가 암환자에게 희망을 주고 있다. 일본 도쿄 아베종양내과병원의 아베 히로유키 이사장이 개발한 다가(多價) 신(新)수지상세포 암백신 ‘아베백스’가 진행성 암환자에서 종양 축소 및 제거, 생존기간 장기 연장 등 지속적인 치료효과를 보이고 있다.
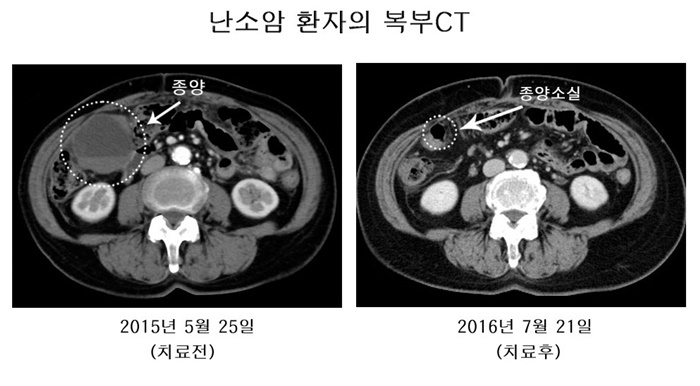
이 병원에 따르면 복부로 전이된 말기 난소암 환자 A씨는 아베백스로 치료받은 지 1년 2개월 만에 컴퓨터단층촬영(CT) 결과 복부 종양이 소실됐다. 이밖에 수술·화학항암제·방사선 등 표준치료를 할 수 없는 난소암 환자 총 12명이 1000일 이상 생존하고 있다.
췌장암 환자 42명 중 18명(42.9%)은 아베백스에 지속적 치료반응을 보이고 있다. 기대여명이 6~7개월로 여겨지는 췌장암 환자는 기존 항암제로 치료할 경우 5년 장기생존율이 약 9%에 그친다.
유방암 환자 26명 중 11명(42.3%)도 우수한 치료효과 얻었으며 1000일 이상 생존하고 있다. 치료반응이 약하게 나타난 15명(57.7%)도 800일 이상 생존하고 있다. 표준치료가 듣질 않는 폐암 환자 22명 중 15명(68.2%), 대장암 환자 32명중 19명(59.4%)도 장기간 치료효과를 보이고 있다.
이같은 연구결과는 지난달 14일 중국 상하이에서 열린 ‘제14회 국제수지상세포학회’와 29일 일본 도쿄에서 개최된 ‘제22회 국제개별화의료(개인맞춤의학)학회’에서 연이어 발표됐다.
아베 박사는 같은 암종이라도 환자별로 암세포 표면의 항원 종류가 다양하다는 사실에 착안해 아베백스를 개발했다. 기존 수지상세포 암백신의 종양제거 능력이 떨어지는 단점과 수지상세포를 다량으로 배양하는 데 필요한 채혈 과정 등을 개선했다. 그는 신수지상세포 암백신 제조기술 관련 2014년 7월 일본에서, 지난 4월 미국에서 특허를 취득했다.
아베백스의 핵심은 한마디로 수지상세포의 능력을 극대화하는 데 있다. 수지상세포(Dendritic Cell)는 면역계의 사령관으로 암을 표식하는 항원 펩타이드(단백질 조각)를 T세포에 제시해 킬러T세포(세포독성T림프구, Cytotoxic T Lymphocyte, CTL)가 특정 항원을 가진 암세포를 찾아 공격하도록 지시한다.
수지상세포는 잡아먹은 항원을 조각내고, 표면의 MHC(주조직 적합복합체, Major Histocompatibility Complex) 분자를 통해 항원을 T세포의 항원수용체(TCR, T cell receptor)에 제시한다. T세포 등 면역체계는 이를 인식해 암세포 살상 시스템을 작동시킨다. 아베백스의 항원 펩타이드는 상대적으로 길어서 수지상세포 표면에서 킬러T세포를 활성화하는 MHC-1과 보조T세포(helper T cell) 및 기억T세포(memory T cell)를 활성화하는 MHC-2에 모두 작용한다. 따라서 항원 펩타이드의 길이가 짧아 MHC-1에만 작동하는 기존 수지상세포 암백신보다 면역체계를 강하게 활성화하고, 암 재발을 효과적으로 방지한다. 아베백스는 수지상세포와 암항원 간 결합력도 강화됐다.
참고로 후천성 면역세포인 킬러T세포는 선천성 면역세포인 NK세포보다 그랜자임이나 퍼포린 등 세포독성물질을 분비해 암세포를 직접 죽이는 능력이 뛰어나다. 표면에 CD8 단백질을 갖고 있는 게 특징이다. 후천성 면역은 항원 자극에 의해 만들어지는 획득면역반응인 반면 선천성 면역은 자연적으로 지니고 있는 저항력이다.
보조T세포는 사이토카인(면역단백질)의 일종인 인터페론-감마와 다양한 인터루킨(IL) 등을 분비해 특정 항원과 반응하는 항체 생산을 촉진한다. 표면에 CD4 단백질을 갖고 있다. 기억T세포는 잠재적인 T세포로서 재침입한 항원을 빠르게 공격한다.
아베백스는 New WT1,MAGE-A3,Her2,GV1001,Survivin 등 총 15여가지의 최신 암항원 중 환자별 암세포 특성에 맞는 5종(평균)을 선택해 수지상세포에 접합시킨다. 이와 달리 기존 수지상세포 암백신은 특정 항원 펩타이드만 사용해 위장하거나 분자 수준으로 작아 공격하기 힘든 암세포를 포착해 제거하는 데 한계가 있었다. 암환자의 유전체정보 분석을 통해 새로운 암항원을 발굴할 때마다 항원 펩타이드를 만들어 암백신에 적용할 수 있는 게 강점이다.
더욱이 아베 박사는 암항원에 HSP(열충격단백질, HEAT SHOK PROTEIN)를 추가해 암치료율을 높였다. HSP는 손상된 세포를 회복시키는 단백질로 암세포와 결합하면 NK(자연살해)세포가 암세포를 쉽게 발견해 공격하도록 유도한다. NK세포는 암세포 등 비정상세포를 스스로 식별해 직접 공격하며 사이토카인 분비를 촉진해 다른 면역세포의 기능을 강화한다.
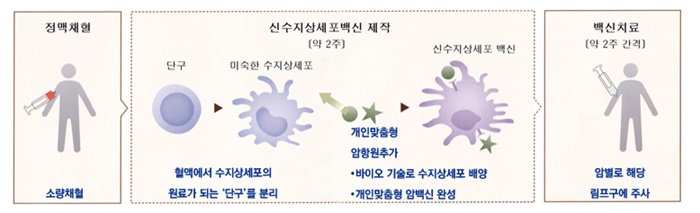
아베백스 치료는 환자의 정맥혈 약 25㎖를 채취해 수지상세포의 원료가 되는 단구를 분리하는 것으로 시작된다. 2~3시간에 걸쳐 5000㎖의 혈액에서 성분을 채혈하는 기존 제조법에 비해 환자의 치료부담이 대폭 줄었다. 환자의 유전자·조직적합성항원(HLA)·종양마커 등을 종합검사한 뒤 환자에 맞는 암항원 4~6개를 선택해 수지상세포와 함께 약 2주간 배양하면 된다.
아베백스는 수지상세포와 킬러T세포 간의 암세포 관련 정보교환이 이뤄지는 림프절에 피하주사해야 효과가 빠르고 정확하게 나타난다. 2주 간격으로 6회 치료(1사이클)하며 6개월가량 항암효과가 지속된다. 1회 치료비용은 약 550만원 이상으로 건강보험이 적용되지 않는다.
치료성과는 혈액검사와 영상진단으로 판정하며 킬러T세포와 보조T세포의 활성도는 인터페론-감마와 인터루킨-4(IL-4) 등의 활성도로 확인한다. 환자 자신의 혈액을 이용하고 특정 암항원을 가진 암세포만 선택적으로 제거하므로 면역거부반응 또는 정상세포를 공격하는 등 부작용은 거의 발생하지 않는다.
다양한 암항원 가운데 GV1001은 2014년 9월 식품의약품안전처로부터 혈청 이오탁신(eotaxin) 농도 81.02pg/㎖ 이상인 국소진행성 또는 전이성 췌장암 환자에 대해 기존 화학항암제와 병용하는 신약으로 허가받았다. GV1001 단일 항원을 가진 암백신으로는 카엘젬백스의 ‘리아백스주’(성분명 테르토모타이드, tertomotide)가 출시된 상태다.
아베 박사는 GV1001 외에 다양한 항원을 포함한 다가 암백신이 췌장암 외에 다른 암에서도 효과가 있는 것을 확인하고 일본에서 폐암·위암·췌장암·유방암 등 암종별 환자 40명씩 총 160명을 대상으로 3년여간 추가적인 임상연구를 진행하고 있다.
아베종양내과와 암백신 치료법을 공동 연구하고 있는 양동근 선진바이오텍 대표는 “수지상세포·NK세포·T세포 등 면역세포를 활용한 항암치료의 관건은 단순히 면역체계를 강하게 활성화하는 것을 넘어 치료표적인 암세포를 얼마나 잘 인식해 제거하느냐”라며 “아베백스에 사용되는 암항원은 미국 식품의약국(FDA), 유럽식약청(EMA), 일본 후생노동성 등의 공식 허가를 받았다”고 설명했다. 그는 “아베 박사와 함께 학회를 통해 치료효과를 입증한 임상데이터를 정기적으로 발표하며 연구개발을 지속하고 있다”고 덧붙였다.
양 대표는 “병원에서 포기할 정도로 면역력이 고갈된 환자에겐 신수지상세포 암백신 치료성공률도 낮을 수밖에 없다”며 “영양관리 등을 통해 치료 전부터 면역력을 일정한 수준 이상 유지하는 게 중요하다”고 설명했다. 이어 “시한부 선고를 내린 암환자가 아베백스로 치료된 뒤 의료진이 깜짝 놀라는 경우가 있지만 아베백스를 비(非)과학적인 만병통치약으로 생각하는 것은 금물”이라고 당부했다.
아베 박사는 지난 6월 일본 도쿄에서 열린 ‘제2회 임상면역백신’ 포럼에서 ‘다가 신수지상세포치료와 항 PD-1(programmed cell death receptor-1, 프로그램된 세포사멸 수용체-1) 면역항암제 사용’을 주제로 발표하며 “오노약품공업과 BMS제약의 항PD-1 면역항암제 ‘옵디보’(성분명 니볼루맙, nivolumab) 등이 일본에 출시되면서 실제 암치료 초기 단계부터 수술·화학항암제·방사선치료 등 기존 표준요법에 신수지상세포 암백신 또는 면역항암제를 병행하는 사례가 늘고 있다”고 말했다.
그는 2000년부터 암과 면역요법에 관한 임상연구를 시작해 2007년 수지상세포 암백신을 진료현장에 도입했다. 학술적 공로를 인정받아 고(故) 랠프 슈타인만(Ralph Steinman) 미국 록펠러대 의대 면역학 교수를 주축으로 구성된 국제수지상세포학회의 소수정예 영구회원으로 등록돼 있다. 슈타인만 교수는 수지상세포의 면역학적 기능을 밝힌 연구로 2011년 노벨생리의학상을 받았다.
아베 박사는 독자적인 기술을 바탕으로 신수지상세포 암백신과 함께 선천성 면역세포인 NK세포·NKT세포·감마델타T세포 등을 고활성화한 ‘복합면역세포치료제’를 병용 투여하는 치료법을 개발했다. NKT세포는 인터페론-감마 등을 분비해 NK세포와 킬러T세포의 종양제거 능력을 향상시킨다. 감마델타T세포는 인터루킨-2(IL-2) 등을 방출해 NK세포가 암세포를 공격하게 한다.

