- 작년 허가품목수 전년 대비 42% 감소 … 슈펙트, 제미글로, 헌터라제 등 신약개발 성과 돋보여
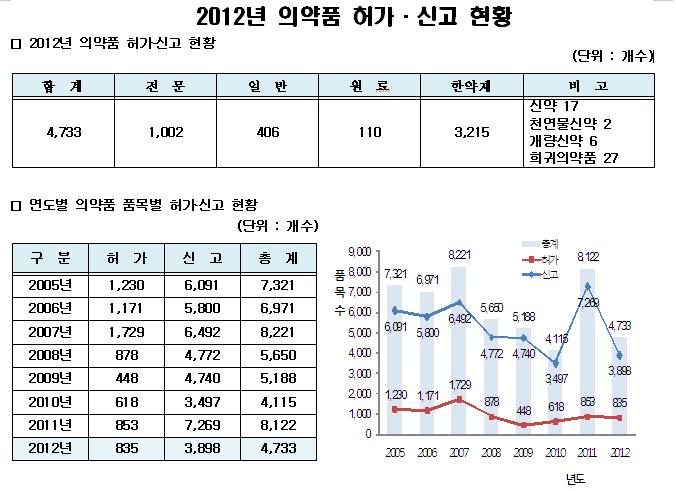
지난해 의약품 허가 품목 건수는 작년 대비 42% 감소했지만 국내 신약개발 및 희귀의약품의 신규허가는 증가해 그동안의 양적 팽창을 접고 질적 성장으로 접어든 것으로 분석됐다. 식품의약품안전청은 ‘2012년 의약품허가(신고)현황’을 분석한 결과, 허가된 품목수는 4733개로 전년도(8122개)에 비해 42% 정도 감소했다고 25일 밝혔다.
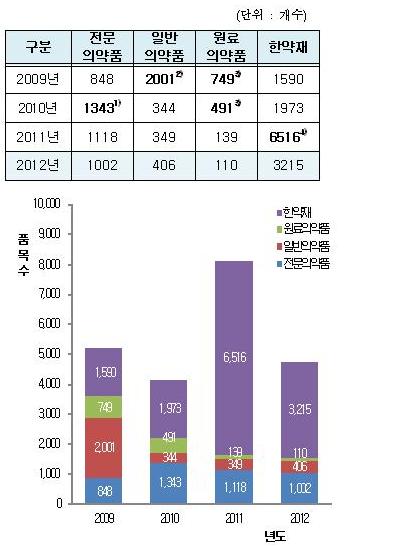
2008년에 의약품 생산기준을 국제 수준으로 높이고 서류제출을 간소화하되 식약청 공무원과 사전에 이를 논의해 점검받는 이른 바 ‘품목별 사전 GMP’(의약품 제조 품질관리 기준 제도, Good Manufacturing Practice) 실시 후 국내 제약업계의 산업구조가 소품목 대량생산으로 재편되고 있어 허가신청이 증가하지 않기 때문이다. 한약재는 2011년 6516개에서 2012년 3215개로, 의약품은 같은 기간 1606개에서 1518개로 약 5% 감소했다.
식약청은 지난해 국내 제약사가 투자를 늘렸고 정부가 신약개발 R&D 지원 및 사전 검토제도 운영 등 제도적 지원을 해 의약품 개발이 질적으로 성장했다고 설명했다.
국내 제약사 연구개발비는 2007년 4712억원에서 2011년 9768억원으로 4년 동안 약 5000억원 이상 증가했다. 국가 R&D 지원액은 2011년 150억원에서 2013년 360억원으로 약 210억원 늘었다. 이에 힘입어 국내 개발 신약은 백혈병 치료제 ‘슈펙트캡슐 100㎎(성분명, 라도티닙 100㎎) 과 200㎎(성분명, 라도티닙 200㎎)’, 당뇨병 치료제 ‘제미글로정(성분명, 제미글립틴 50㎎)’ 3품목이 허가됐다. 이런 지속적인 신약개발은 약가 인하 등으로 어려운 시장상황을 극복하겠다는 국내 제약사의 의지를 보여준다.
 2009년~2011년 대비 2012년 의약품 허가·신고 현황
2009년~2011년 대비 2012년 의약품 허가·신고 현황
개량신약은 암, AIDS 환자의 식욕부진 및 원인불명의 체중감소 치료제인 ‘애피트롤이에스 내복 현탁액(성분명, 초산메게스트롤 12.5g)’ 등 6 품목이 허가돼 2011년 2개 품목에 비해 다소 늘었다.
수입에만 의존하던 ‘헌터라제(헌터증후군)’과‘애브서틴(고셔병)’ 2개 품목이 국내 최초 희귀의약품으로 허가됐다. 이밖에 생물의약품은 바이오시밀러로 국내에서 개발된 ‘램시마(류마티스관절염)’와 세포치료제인 ‘카티스템(골관절염)’ 및 ‘큐피스템(크론병)’ 2개 품목이 환자에게 새로운 치료기회를 제공하게 됐다.
지난해 허가품목 중 한약재, 원료의약품을 제외한 1408개를 약효군별로 분석한 결과 △해열·진통·소염제 등 신경계의약품(269개, 19%) △ 골다공증치료제 등 대사성의약품(200개, 14%) △고혈압치료제 등 순환계의약품(162개, 11%)순이었다.
대사성의약품은 골다공증치료제 개발(53개)이 활기를 띠면서 2011년(10개)에 비해 상승폭이 가장 컸다. 발기부전치료제 등 비뇨생식기관용의약품은 2011년 20개에서 지난해 79개로 증가했다. 반면 2011년 가장 많이 허가된 순환계의약품은 특허만료에 따른 제네릭 의약품연구개발이 감소해 허가 품목수가 크게 줄었다.
한편 전문의약품과 원료의약품의 허가 품목수는 10년 이후 매년 소폭 감소했으나, 일반의약품은 신경계의약품(해열·진통·소염제) 등 개발 등으로 꾸준히 증가했다.
전문의약품의 허가 품목수는 2010년(1343개) 대비 341개, 원료의약품은 2010년(491개) 대비 381개가 각각 감소했다. 반면 일반의약품은 62개 증가했다.
식약청은 국내 제약산업의 지원 및 수출 경쟁력 강화를 위해 규제 선진화, 사전검토제 운영, 최신 과학기술개발에 따른 평가체계 구축으로 의약품 허가를 합리적으로 지원하겠다고 밝혔다.
2009년~2011년 대비 2012년 의약품 허가·신고 현황

