- 간염은 12~18세, 에이즈는 2~18세로 허용 … 1일 1회 복용, 과립형·저용량 정제 출시
길리어드사이언스의 ‘비리어드’가 새로운 적응증과 제형을 추가했다. 이 회사는 최근 유럽위원회(European Commission)로부터 비리어드(성분 테노포비어, tenofovir)가 대상성 간질환과 면역활성 질환이 확인된 12~18세 청소년의 만성 B형간염 치료와 인간 면역결핍 바이러스(human immunodeficiency virus-1, HIV-1)에 감염된 2~18세 소아·청소년의 치료에 사용할 수 있도록 1일 1회 복용 적응증을 추가로 승인받았다고 15일 밝혔다.
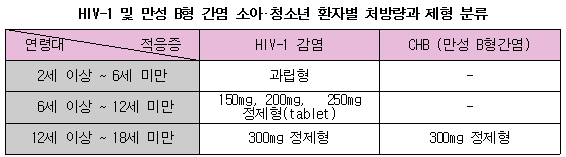
이와 함께 유럽위원회는 어린 환자의 복용을 위해 과립형 및 저용량 비리어드의 판매허가를 승인했다. 과립형 비리어드는 2~6세 미만의 소아와 고형제제 복용이 어려운 6세 이상의 HIV-1소아 환자에게 사용된다. 6~12세의 HIV-1 소아 환자는 연령과 체중을 고려해 150㎎, 200㎎, 250㎎ 중 하나를 선택하면 된다.
이번 적응증 확대 승인으로 2~18세 HIV-1소아 환자 중 뉴클레오사이드 역전사효소 억제제(Nucleoside reverse transcriptase inhibitors, NRTI)에 저항성이나 독성이 있어 소아용 1차 제제를 사용할 수 없는 경우에 비리어드와 다른 항레트로바이러스 제제를 병용 투여할 수 있다. 또 기존의 비리어드 300㎎은 유럽의 경우 12~18세 청소년의 HIV-1 감염 치료나 대상성 만성 B형간염 치료제로 사용할 수 있다. 300㎎ 정제를 복용하기에 적합하지 않은 청소년이나 성인은 과립형 비리어드로 치료받을 수 있다.
 길리어드사이언스의 ‘비리어드’
길리어드사이언스의 ‘비리어드’
노벌트 비쇼프버거(Norbert Bischofberger) 길리어드사이언스 연구개발부 최고책임자 부사장은 “이번 적응증 확대를 통해 만성 B형간염과 HIV 감염을 앓고 있는 어린 환자에게 새로운 치료적 대안을 제공할 수 있게 됐다”며 “소아용 제형의 비리어드로 가능한 빨리 치료받을 수 있도록 하겠다”고 말했다.
비리어드는 2002년 성인 HIV-1 감염 치료제로 출시돼 2008년 만성 B형간염 치료 적응증을 추가했다. 주요 유럽국가를 포함한 전세계에서 HIV-1 및 만성 B형간염 치료에 가장 많이 처방되고 있다.
 길리어드사이언스의 ‘비리어드’
길리어드사이언스의 ‘비리어드’
