10년 이상 준비해온 ‘아프리카의약품청’(African Medicines Agency, AMA)이 공식 출범한다. 아프리카의약품청은 11일부터 13일까지 케냐 몸바사에서 열리는 ‘아프리카 의약품 규제 당국 회의’에서 공식 출범을 선언할 예정이다.
AMA의 출범은 단순한 규제기관 설립을 넘어, 아프리카 대륙의 보건·의약품 주권 확립을 상징하는 조치로 평가된다. 수십 년간 외부 국가의 승인 체계에 의존해온 아프리카는 자금 부족과 관리 부재로 위조·불량 의약품 유입이 쉬운 환경에 놓여 있었다. AMA는 이를 개선하기 위해 아프리카인의 생물학적 특성과 유전체 정보를 신약개발 및 임상시험 단계부터 반영하는 새로운 규제 표준을 마련할 계획이다.
현재 아프리카 대륙은 전 세계 인구의 약 18%를 차지하지만, 1999년부터 2024년까지 전 세계에서 수행된 임상시험(128만6976건) 중 아프리카에서 진행된 비율은 2.4%(3만967건)에 불과하다. 특히 최근 8년간(2015~2023년) 1상 임상시험 가운데 케냐 17건, 나이지리아 12건, 에티오피아 3건만이 아프리카 대륙에서 수행된 것으로 나타났다. 한국바이오협회 관계자는 “아프리카의 유전적 다양성이 임상 연구에서 거의 고려되지 않았다”며 AMA 출범이 이를 반전시킬 계기가 될 것으로 내다봤다. 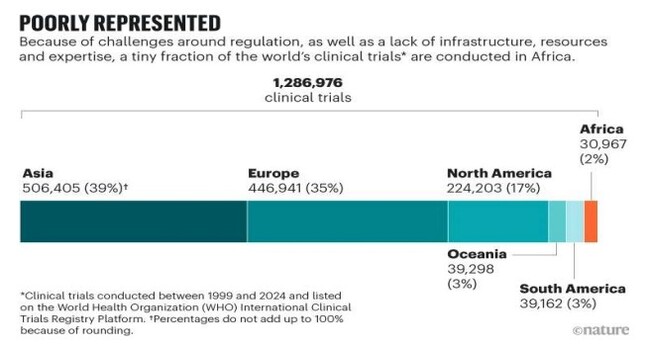 ‘Nature’에 게재된 대륙별 임상시험 건수와 비중
‘Nature’에 게재된 대륙별 임상시험 건수와 비중
아프리카의약품청은 2017년 설립된 아프리카질병관리청(Africa Centers for Disease Control and Prevention, Africa CDC)에 이어 아프리카연합(AU) 차원의 두 번째 보건 규제기관이다. AMA는 의약품과 의료기기의 안전·품질·접근성 보장을 위한 허가 체계를 구축하고, 회원국 간 규제 조화를 촉진하는 역할을 맡는다.
한국바이오협회는 “AMA가 공식 출범함에 따라 초기 단계에서 우리나라 제약바이오 기업이 선제적으로 관계를 구축한다면, 향후 의약품 및 의료기기 허가·등록 절차 간소화와 신뢰도 제고, 비관세장벽 해소 측면에서 유리한 위치를 점할 수 있을 것”이라고 밝혔다. 이어 “AMA와의 조기 협력이 국내 기업과 제품의 국제적 신뢰를 확보하는데 중요한 전환점이 될 것”이라고 덧붙였다.
한편 유럽의약품청(EMA)은 올해 1월 유럽집행위원회(EC)로부터 1000만유로(약 170억원)를 지원받아 AMA 설립을 지원하겠다고 발표한 바 있다.

