 리제네론은 자사 이중항체 후보 린보셀타맙(linvoseltamab, REGN5458) 관련 FDA 재승인신청이 수락됐다고 11일 밝혔다. 승인결정예정일은 5개월 후인 7월 10일로 잡혔다.
리제네론은 자사 이중항체 후보 린보셀타맙(linvoseltamab, REGN5458) 관련 FDA 재승인신청이 수락됐다고 11일 밝혔다. 승인결정예정일은 5개월 후인 7월 10일로 잡혔다.
앞서 위탁 제조사 관련 시설 문제로 인해 지난해 8월 FDA로 부터 한차례 승인 거부된 바 있다. 해당문제 해결 후 이번에 재승인신청을 진행하게 됐다.
린보셀타맙은 B세포 성숙 항원(BCMA)과 CD3 표적의 이중항체로, 암세포의 BCMA에 결합하고 CD3 항체 발현 T세포의 활성화를 통해 암세포의 괴사를 유도하는 기전이다.
동일기전으로 다발성 골수종을 적응증으로 승인된 품목은 존슨앤드존슨의 텍베일리(성분명: 테클리스탐맙, Tecvayli)는 2022년 FDA로부터 승인을 받았으며, 화이자의 엘렉스피오(성분명: 엘란타맙, Elrexfio)는 2023년 FDA 승인을 받았다.
승인신청 LINKER-MM1 1/2상(NCT03761108)이 기반으로 한다. 4차 치료 환경의 참가자 대상 11개월 추적 관찰 결과 200mg 용량군에서 객관적 반응율은 71%였다. 추가적으로 반응 지속기간, 무진행생존기간, 최소잔존질환(MRD) 음성률, 전체생존율(OS) 등을 평가하고 있다.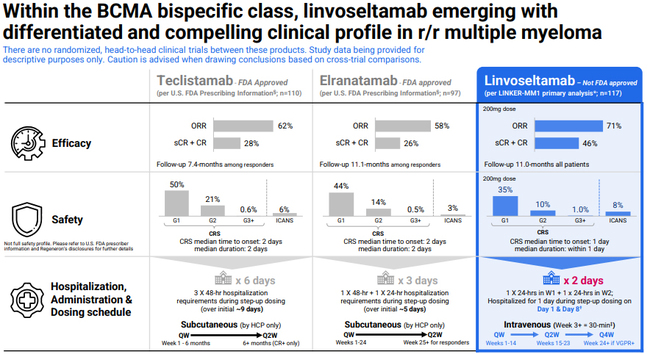 출처: 리제네론
출처: 리제네론
리제네론은 현재 린보셀타맙을 단독요법뿐만 아니라 다양한 병용요법으로도 개발하고 있으며 확증 임상 격인 LINKER-MM3 3상(NCT05730036)을 통해 BMS와 애브비의 엠플리시티(레날리도마이드 및 덱사메타손과의 병용요법)를 대조군으로 3차 치료 환경에서 효과와 안전성을 평가하고 있다.
다양한 병용요법 중하나로 자사와 사노피의 듀피젠트(두필루맙)과 병용을 통해 중증 음식 알레르기 치료 가능성을 평가하고 있다.
FDA 승인 검토와 더불어 유럽승인신청도 수락돼 현재 검토가 진행중에 있다.