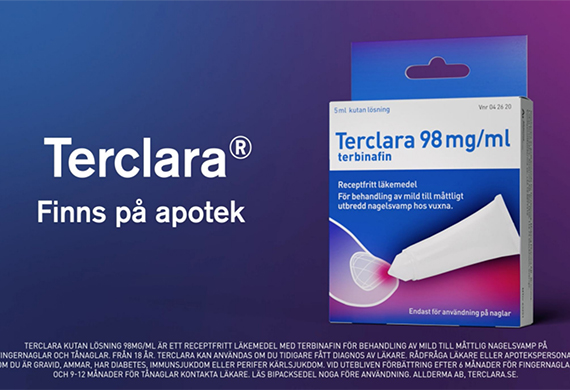
 스웨덴에서 출시된 'MOB-015/ 상품명 Terclara바이엘은 손발톱진균증 치료를 위한 일반의약품 국소도포제 'MOB-015'(국소 테르비나핀)의 유럽 판권을 개발사인 스웨덴 소재 모베르그 파마(Moberg Pharma)에 반환했다.
스웨덴에서 출시된 'MOB-015/ 상품명 Terclara바이엘은 손발톱진균증 치료를 위한 일반의약품 국소도포제 'MOB-015'(국소 테르비나핀)의 유럽 판권을 개발사인 스웨덴 소재 모베르그 파마(Moberg Pharma)에 반환했다.
모베르그 파마는 10일 유럽내 국가별 분산 승인철차를 통해 총 13개국에서 승인 받은 국소용 테르비나핀 제제 MOB-015의 북미지역 3상에서 1차 유효성 평가 목표 달성에 실패했다고 발표했다. 이에 따라 미국 포함 북미지역 공량에 대한 계획을 회사는 유럽 시장 공략으로 전환하고, 바이엘(Bayer)과 체결했던 유럽 판권 관련 라이선스 계약을 해지했다고 발표했다.
북미 지역(미국·캐나다) 3상은 1일 1회 지속투여 했던 유럽 승인 기반 임상과 달리 MOB-015 8주간 1일 1회 도포 후 40주간 주 1회 유지치료를 통해 손발톱진균증의 치료효과를 위약대비 평가했으나 1차 평가지표 달성에 실패했다. 회사는 매일 도표하는 장기치료 전략이 효과적이라는 점만 재입증하게 됐다고 의미를 설명했다.
북미 임상 실패의 직접적인 영향으로, MOB-015의 유럽 내 공동 마케팅을 준비해온 바이엘은 전략적 재검토를 거쳐 출시를 철회키로 결정했다. 바이엘과 모베르그 파마는 상호 합의를 통해 라이선스 계약 종료 의사를 밝힌 상태이며, 모베르그 파마는 유럽 시장에 대한 모든 라이선스를 다시 확보하게 된다.
양사는 2019년 계약금 150만 유로를 지불하고 최대 5천만 유로의 마일스톤을 약속하고 유럽 판권계약을 체결한 바 있다. 참고로 국내의 경우 같은 해인 2019년 동구 바이오제약과 판권 계약을 체결한 바 있다.
MOB-015는 현재 스웨덴에서 상품명 ‘Terclara’으로 출시됐다. 북미 3상의 부정적 결과에 따라 미국시장 진출전략을 재검토하는 한편 유럽시장에서는 바이엘과의 협업 종료에 따라 직접 판매 또는 파트너사들과 협상을 통해 간접판매 전략을 펼친다는 계획이다.
모베르그 파마의 CEO 안나 융(Anna Ljung)은 “북미 임상 결과로 인한 새로운 환경 속에서도 MOB-015의 우수한 효능은 변함없다”며 “유럽 시장을 발판으로 보다 높은 부가가치를 창출하겠다”고 강조했다.
MOB-015의 성분은 테르비나핀. 오리지널 약품은 널리알려진 노바티스의 무좀치료제 '라미실'이다. 약물재창출를 통해 다른 적응증인 적응증손발톱진균증 치료제됐다. 유럽승인의 경우 EU 중앙집중식 승인 아닌 국가별 개별승인 경로를 통해 승인을 받아 총 13개국에서 승인됐다.

