식품의약품안전처는 국내 제네릭 의약품 개발을 지원하기 위해 2025년부터 2027년까지 재심사 기간이 만료될 예정인 의약품 379개 품목의 특허 정보를 12일 공개했다.
식품의약품안전처는 국내 제네릭 의약품 개발을 지원하기 위해 2025년부터 2027년까지 재심사 기간이 만료될 예정인 의약품 379개 품목의 특허 정보를 12일 공개했다.
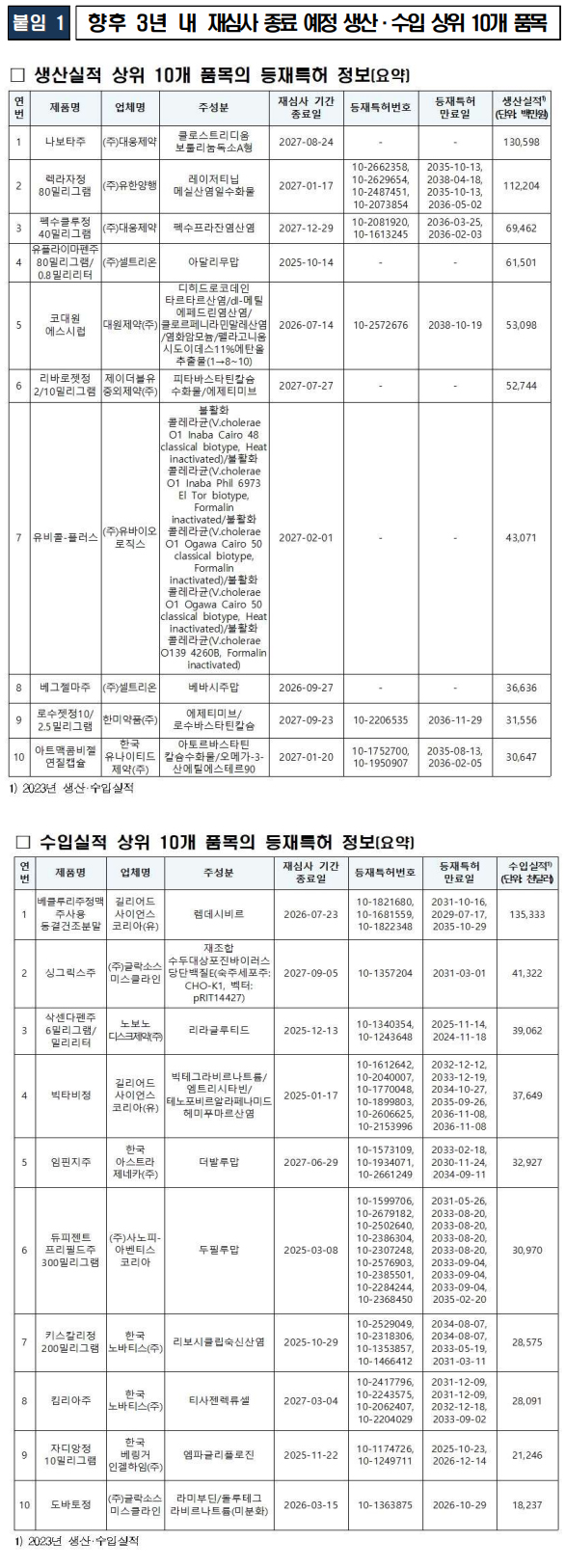
이번 공개 품목에는 레이저티닙 제제(렉라자정), 펙수프라잔 제제(펙수클루정), 로수바스타틴 복합제(로수젯정) 등 주요 치료제들이 포함됐다. 공개된 정보에는 각 품목의 특허번호, 특허 만료일, 재심사 종료일 및 시장 규모 등이 포함된다.
재심사 제도는 신약 및 일부 전문 의약품의 안전성과 유효성을 재평가하는 시스템으로, 허가 후 일정 기간 부작용 및 효과에 대한 추가 데이터를 수집해 검토하는 절차이다.
이번 정보 공개는 제네릭 의약품 제조사들이 개발 전략을 세우는 데 필요한 기반 자료를 제공하여 국내 의약품 시장의 경쟁력을 높이려는 취지이다. 식약처는 업계의 정보 요구를 충족하며 향후에도 제네릭 의약품 개발 지원을 위해 지속적인 정보 공개를 약속했다.
이번에 공개된 자료는 식약처의 공식 누리집에서 확인할 수 있으며, 제약사들은 이를 통해 시장 진입 시점과 경쟁 상황을 보다 명확히 파악할 수 있게 됐다. 식약처 관계자는 “특허 정보와 시장 규모 등 주요 정보는 제네릭 의약품의 신속한 개발과 비용 효율적 전략 수립에 큰 도움이 될 것”이라며 이번 조치의 중요성을 강조했다.
이번 조치를 통해 향후 3년간 재심사 종료 예정인 의약품 중 수요가 높은 상위 10개 품목도 공개됐다. 식약처는 해당 품목들이 국내 제네릭 의약품 시장의 발전을 촉진하며, 제약업계의 혁신과 가격 경쟁력 강화에 기여할 것으로 기대하고 있다.
앞서 식약처는 다양한 형태의 의약품 정보 제공을 통해 국내 의약품 산업의 투명성을 제고해왔다. 특히 의약품 특허 등록 제도에 따라 의약품 허가와 직접적으로 연관된 특허 정보를 신속하게 전달하며, 제약사들이 시장의 변화에 적시에 대응할 수 있도록 돕고 있다.
한편, 최근 제네릭 의약품 개발의 중요성이 커짐에 따라 정부는 다양한 지원 방안을 검토 중이다.