 휴메딕스 골관절염치료제 '휴미아(HUMIA)'
휴메딕스 골관절염치료제 '휴미아(HUMIA)'
휴온스그룹 휴메딕스는 골관절염치료제 '휴미아(HUMIA)'가 최근 대만 식품의약국(TFDA) 인증을 획득했다고 29일 밝혔다.
휴미아는 1회 투여로 6개월간 약효가 지속되는 지속형 골관절염치료제로 휴메딕스의 독자적인 생체 고분자 응용 바이오 기술에 고순도 히알루론산 생산 기술을 접목해 정상인의 관절 활액 물성과 유사한 구조를 띄고 있다.
휴미아는 국내에서 지난 2019년 국내 식품의약품안전처로부터 품목허가를 취득하고 ‘하이히알원스’ 등의 이름으로 출시돼 의료진과 환자들에게 꾸준한 선택을 받고 있다.
휴메딕스는 이번 TFDA 인증 획득으로 갈수록 치열해지는 대만 골관절염치료제 시장에서 유리한 위치를 차지하게 됐다.
휴메딕스는 앞선 2022년 골관절염치료제 3회 주사 제형인 '하이히알 플러스'로 TFDA인증을 받고 꾸준히 수출 규모를 늘려왔다. 이번 휴미아의 인증 획득으로 대만 시장 공략에 더욱 박차를 가할 계획이다.
휴메딕스는 기존 동일 제제의 골관절염치료제들은 1주 1회씩, 3회 또는 5회를 투여해야 약효가 지속된다. 휴미아는 약효를 1회 투여로 획기적으로 줄여 여러 차례 정기적으로 병원을 방문해야 했던 환자들의 불편함을 해소했다고 회사 측은 설명했다. 이번 제품군 확대를 통해 환자의 상황에 맞는 처방이 가능해질 것으로 기대하고 있다.
김진환 휴메딕스 대표는 "휴미아는 휴메딕스의 생체 고분자 응용 바이오 기술을 집약해 개발한 제품으로 국내에서도 높은 편의성과 우수한 치료 효과를 인정 받고 있다"며 "약 25조원 규모로 추정되는 전 세계 히알루론산 제제 골관절염치료제 시장을 선도하는 제품으로 자리매김하도록 해외 시장 공략에 힘을 쏟겠다"고 말했다.
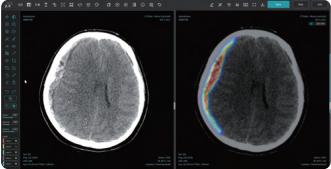 비조영 CT 영상 분석 뇌 경막하 출혈 탐지 솔루션 JLK-SDH
비조영 CT 영상 분석 뇌 경막하 출혈 탐지 솔루션 JLK-SDH
의료 인공지능(AI) 기업 제이엘케이는 올해 본격적인 미국 진출 계획의 일환으로 현지에서 수요가 많은 CT영상 기반 뇌 경막하 출혈 분석 솔루션 JLK-SDH를 새롭게 출시했다고 29일 밝혔다.
JLK-SDH는 뇌를 둘러싼 경막 내부 혈관의 파열로 인한 출혈을 진단할 수 있는 솔루션으로 주로 낙상이나 교통사고 등 외상으로 발생하는 경막하 출혈 환자의 신속하고 정확한 병변 분석을 위해 개발됐다. 일반적으로 경막하 출혈 환자는 두부 외상으로 응급실로 이송되는 경우가 빈번하기에 가장 먼저 CT 촬영을 진행해 진단을 하고 치료 계획을 수립하게 된다.
기존 뇌출혈 진단 솔루션인 JLK-ICH가 주로 전반적인 급성 뇌출혈 진단에 강점을 보인 반면 이번에 출시된 JLK-SDH는 CT에서 신호강도가 강하지 않아 정상 뇌와 구분이 어려운 아급성(subacute) 혹은 만성 경막하출혈 데이터 학습에 공을 들여 어려운 뇌출혈 진단에 강점이 있다고 회사 측은 설명했다.
JLK-SDH는 미국 의료기관의 뇌졸중 진단 시 CT 촬영이 많은 것에 착안해 보강된 CT 솔루션으로, 회사는 미국 시장 진출에 더욱 박차를 가할 계획이다. 미국의 CT 촬상 건수는 연간 8600만 건으로 경쟁사인 비즈 AI(Viz AI)의 CT 기반 인공지능 뇌졸중 솔루션의 한 건당 보험수가는 1040달러(약 140만 원)로 책정돼 있다.
제이엘케이는 CT, MRI 등 다양한 솔루션으로 뇌졸중 전주기를 커버할 수 있는 강점을 적극적으로 내세운다는 전략이다.
김동민 제이엘케이 대표는 "응급 상황에서 빠르고 정확한 진단과 치료를 할 수 있도록 돕는 JLK-SDH 출시로 미국시장 진출에 유용하게 활용될 CT 기반의 뇌출혈 솔루션을 모두 갖췄다. JLK-SDH의 빠른 미국 식품의약국(FDA) 인허가 신청을 위해 집중하고 현지 상황에 맞는 진출 전략을 구상해 미국 시장 선점을 위한 최선의 노력을 다하겠다"고 말했다.
 브릿지바이오테라퓨틱스 로고
브릿지바이오테라퓨틱스 로고
혁신신약 연구개발 전문 기업 브릿지바이오테라퓨틱스(KQ288330)는 28일 오후 온라인 IR 기업설명회를 개최하고, 회사의 선두 과제 개발 현황 및 향후 전망에 대해 소개했다.
최근 3세대 상피세포 성장인자 수용체 티로신 인산화효소 억제제(EGFR TKI) '렉라자(성분명: 레이저티닙)'의 미국 식품의약국(FDA) 승인에 따라 비소세포폐암 치료제 시장이 크게 관심을 받고 있는 가운데, 이번 기업설명회를 통해 회사가 지난해 10월부터 환자 투약을 개시하며 본격 개발하고 있는 4세대 EGFR 저해제 계열 표적 폐암치료제 후보물질 ‘BBT-207’ 임상 1상의 진행 현황이 상세 공개됐다.
회사는 BBT-207 임상 1/2상에 대한 임상시험계획(IND)에 대해 지난해 4월과 8월, 미국 식품의약국 및 한국 식품의약품안전처의 승인을 모두 받았으며, 약물의 약효 확인이 기대되는 올해 4분기 이후 미국의 임상시험기관을 추가로 활성화할 계획이다.
초기 3개 용량군에서 총 10명의 국내 환자가 BBT-207을 투약했으며, 이 가운데 3명의 환자가 종양의 크기에 큰 변화가 없는 '안정병변(Stable Disease)'으로 분류됐다. 지난 달에는 본격적인 약효 신호 확인이 기대되는 네 번째 용량군에 진입했으며, 내년 상반기에는 제2상 권장 용량을 결정하기 위한 임상 1b상에 본격 착수할 전망이다.
이정규 브릿지바이오테라퓨틱스 대표는 "임상 참여 연구자 및 환자들의 적극적인 호응을 바탕으로 임상 참여 환자들을 초과 모집하는 등 선두 과제들의 개발 순항 소식을 전할 수 있어 기쁘다”며 “폐암 및 특발성 폐섬유증 분야에서 환자들에게 새로운 희망이 되는 치료제 개발의 가속화를 위해 힘쓰는 동시에, 다수의 다국적 제약회사들이 주목하는 과제로서 회사의 미래 성장 기틀을 다질 수 있는 양질의 기술이전 체결을 위해 거듭 힘쓸 것"이라고 말했다.
 피플바이오 로고
피플바이오 로고
피플바이오는 말레이시아 보건복지부 산하 의료기기 규제 당국인 Medical Device Authority(MDA)로부터 알츠하이머병 혈액검사에 대한 정식 품목허가를 취득했다고 29일 밝혔다.
지난 1월 말레이시아 최대 의료기기 유통회사이자 글로벌 헬스케어 기업인 ‘DKSH 말레이시아’와 공동사업개발 계약을 체결한 피플바이오는 금번 허가 취득을 계기로 말레이시아 시장에서 알츠하이머 검사 서비스 론칭에 박차를 가할 계획이다.
말레이시아는 총 인구 약 3400만명 중 약 7.5%가 65세 이상으로 고령화 사회에 진입했으며, 전반적인 경제 및 의료산업의 성장으로 노후 건강 및 관리에 대한 관심도가 크게 증가하고 있다.
특히 고령화 사회의 가장 두려운 질병인 알츠하이머병은 문진검사, MRI 등의 검사 후 전문의의 판단이 이뤄지는 것이 일반적인데, 증상이 발현되면 되돌릴 수 없기 때문에 증상이 나타나기 전 바이오마커를 이용한 조기진단이 매우 중요하다.
이에 피플바이오의 알츠하이머병 혈액검사가 말레이시아의 알츠하이머 조기진단 솔루션으로써 큰 역할을 할 수 있을 것으로 기대된다.
피플바이오 관계자는 “당사는 말레이시아 진출을 위해 말레이 대학병원의 친 아이 반(Chin Ai-Vyrn) 박사, 쿠알라룸프르 국립병원의 케니 옹(Kenny Ong) 박사 그리고 말레이시아 최대 사립병원그룹의 모하메드 세니카티(Mohamed Seenikaty) 박사 등 말레이시아를 대표하는 치매전문의(KOL)들을 자문위원으로 위촉했다”며 “DKSH 말레이시아와 함께 올해 현지 대규모 사립병원을 시작으로 알츠하이머 혈액검사 서비스를 론칭할 계획”이라고 밝혔다.
 셀트리온 인플릭시맙 피하주사(SC) 제형 치료제 '짐펜트라'
셀트리온 인플릭시맙 피하주사(SC) 제형 치료제 '짐펜트라'
셀트리온이 글로벌 최대 의약품 시장인 미국에서 대형 보험사 ‘시그나 헬스케어(Cigna Healthcare, 이하 시그나)’와 세계 유일의 인플릭시맙 피하주사(SC) 제형 치료제 ‘짐펜트라’에 대한 선호의약품(preferred drug) 등재 계약을 체결했다고 29일 밝혔다. 이번 계약을 통해 시그나 가입자에 대한 환급이 가능해짐에 따라 미국 내 짐펜트라 처방은 한층 가속화될 전망이다.
시그나는 미국 보험 업계에서 상위 10대 기업에 속하는 대형 기업으로 약 1,610만 명 규모의 가입자를 보유하고 있다. 특히 3대 처방약급여관리업체(Pharmacy Benefit Manager, 이하 PBM) 중 하나인 익스프레스 스크립츠(Express Scripts, 이하 ESI)와 함께 시그나 그룹(Cigna Group)에 속해 있다.
미국에서는 최근 의료 시장에서의 영향력 강화를 위해 보험사, PBM, 전문약국(Specialty Pharmacy) 및 의약품구매대행사(Group Purchasing Organization, GPO) 등을 하나의 그룹에서 통합 운영하는 추세가 늘어나고 있다.
시그나 그룹은 산하에 보험사인 시그나 헬스케어를 비롯해 PBM으로는 ESI, 전문약국에 아크레도(Accredo) 등을 보유하고 있어 미국 의료 시장에서 영향력이 상당한 것으로 알려져 있다.
이번 성과는 짐펜트라 미국 출시 5개월여 만에 3대 PBM과 등재 계약을 체결한데 이어 굴지의 대형 보험사와도 등재 계약을 완료했다는 점에서 큰 의미를 가진다. 셀트리온은 지금까지 시그나를 비롯한 다수의 보험사 및 전국형-지역형 PBM 등 총 26개 처방집에 짐펜트라 등재를 완료하며 처방 확대를 위한 기반 마련을 순조롭게 이어가고 있다.
커버리지로 환산할 경우 미국 보험 시장에서 약 75%를 달성한 셈이다. 셀트리온은 여러 보험사 및 PBM들로부터 짐펜트라 문의가 이어지고 있는 만큼 올 연말까지 미국 보험 시장 전체를 확보한다는 계획이다.
셀트리온은 커버리지 확보를 넘어 짐펜트라의 실제 처방이 확대될 수 있도록 의료진 및 환자 모두를 아우르는 맞춤형 마케팅 활동을 전방위적으로 강화해 나간다는 전략이다.
이를 위해 미국 내 주요 의사 대상 네트워크 강화에 나서는 한편, 다음 달부터는 미국 전역에서 송출되는 짐펜트라 TV 및 SNS 광고를 개시해 일반인을 대상으로 한 인지도 제고 활동도 본격화할 예정이다. 이러한 활동을 통해 출시 2년 차인 2025년까지 짐펜트라의 미국 시장 점유율을 최소 15% 이상 끌어올린다는 목표다.
셀트리온 미국 법인 프랜신 갈란테(Francine Galante) 마켓 액세스(Market Access) 총괄 책임자는 “셀트리온은 혁신적이고 효과적인 치료 옵션에 대한 접근성을 높이기 위해 최선을 다하고 있으며, 시그나 및 ESI 등과의 파트너십을 통해 의사 및 환자들의 치료 옵션이 보다 확대될 것으로 기대된다”며 “짐펜트라는 치료 효능 및 안전성이 입증된 고품질의 바이오 의약품을 집에서 간편하게 자가 투여할 수 있다는 점에서 환자의 질병 관리에 상당한 유연성을 제공하는 만큼 미국 염증성 장질환(IBD) 시장에 상당한 가치를 제공할 것”이라고 말했다.

