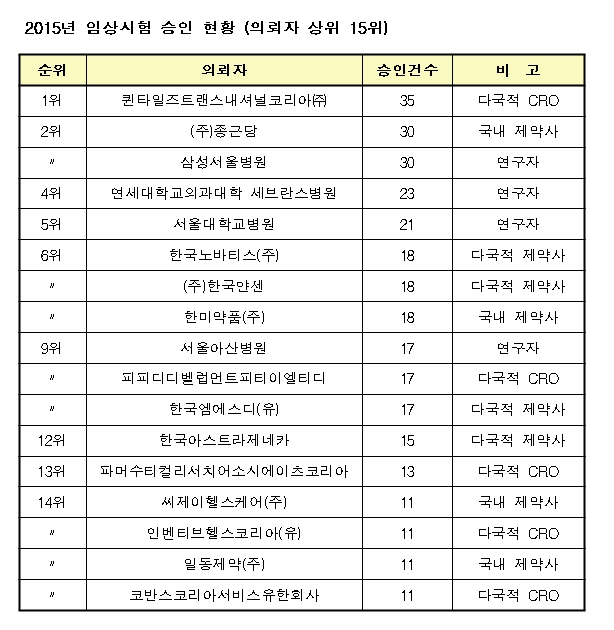
지난해 식품의약품안전처로부터 승인된 임상시험 수가 전년 대비 3.5% 증가한 675건인 것으로 조사됐다. 효능군별로는 항암제가 255건, 제약사별로는 종근당이 30건으로 가장 많았다.
식약처는 이같은 내용을 담은 ‘2015년 임상시험 계획 승인현황 분석자료’를 25일 발표했다. 자료에 따르면 국내 제약사 임상시험 승인건수는 245건으로 전년과 비교해 11% 늘었으며, 다국적 제약사의 승인건수도 3.9% 증가한 것으로 나타났다.
지난해 국내 제약사의 1상 임상시험 승인건수는 148건으로 2014년 152건에 비해 다소 감소했다. 2상 임상시험은 42건으로 2014년 25건과 비교해 68% 늘었다. 3상 임상시험도 53건으로 2014년 42건 대비 26% 증가했다. 다국적 제약사는 그동안 3상에 집중됐지만 지난해에는 3상이 다소 감소한 반면 1상과 2상은 늘었다. 이는 국내 임상시험기관의 인력, 시설 등 인프라가 잘 갖춰져 국내 임상시험 수행에 대한 신뢰도가 높아진 것이 원인으로 꼽힌다.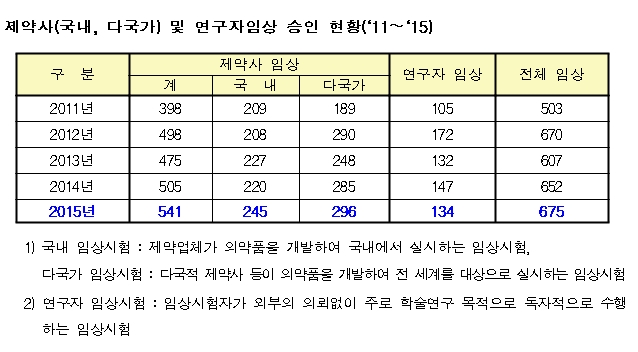
효능군별로는 항암제가 255건으로 가장 많았고 심혈관계 76건, 중추신경계 46건, 내분비계 42건 순이었다. 최근 주목받고 있는 바이오의약품은 유전자재조합의약품이 159건으로 최다 승인을 받았고 세포·유전자치료제(30건), 생물학적제제(14건) 등이 뒤를 이었다.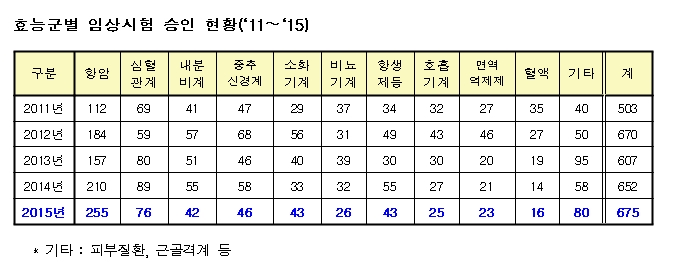
지역별로는 서울(1704건, 55.7%)과 경기도(440건, 14.4%)에서 수행되는 임상시험이 전체의 약 70%를 차지하는 것으로 나타났다. 이어 부산(196건, 6.4%), 대구(164건, 5.4%), 인천(121건, 4.0%) 순이었다. 임상시험 실시기관별로는 서울대병원(253건, 8.2%), 서울아산병원(243건, 7.9%), 삼성서울병원(239건, 7.8%), 연세대 세브란스병원(224건, 7.3%), 가톨릭대 서울성모병원(133건, 4.3%) 순으로 많았으며 이들 5개 대형병원의 점유율이 전체의 35.7%를 차지했다.
국내 제약사는 종근당이 30건으로 가장 많은 임상시험을 승인받았다. 한미약품(18건), 일동제약(11건) 등이 뒤를 이었다. 다국적 제약사의 경우 한국노바티스(18건), 한국얀센(18건), 한국엠에스디(17건), 한국아스트라제네카(15건) 등이 상위권에 이름을 올렸다.