식품의약품안전처가 줄기세포치료제 개발 현황을 조사한 결과 국내 임상은 총 40건으로 미국에 이어 2위이며, II/III상의 비율이 높은 것으로 나타났다.
임상연구 현황은 미국 임상연구 등록사이트(www.clinicaltrials.gov)에 등록된 줄기세포치료제를 이용한 1046건의 임상연구중 제품화를 위해 진행 중인 258건을 선별해 국가별, 환자수 등 임상규모별, 세부질환별, 임상단계별 등으로 분석한 결과를 담고 있다.규제정보에는 미국과 유럽연합의 세포치료제 허가 및 관리제도, 비임상연구 지침 등 의약품 규제기관에서 정한 규정 정보를 포함하고 있다.
식약처는 이같은 내용을 담은 ‘줄기세포치료제 개발 및 규제동향 2013’을 오는 28일 발간한다고 밝혔다.
개발 국가별 임상점유율은 미국이 136건으로 가장 많고, 한국(40건), 중국(17건), 스페인(17건) 순이었다. 2013년 6위를 차지했던 스페인은 중국과 나란히 3위를 차지했다. 2013년도에 각각 4위와 5위를 차지한 인도와 이스라엘은 비슷한 수준을 유지했으며, 파나마는 4건으로 새로운 임상개발국에 진입했다. 일본의 상업적 임상은 1건으로 정부주도의 비상업적 경로를 통한 임상연구가 진행되고 있는 것으로 것으로 예측된다.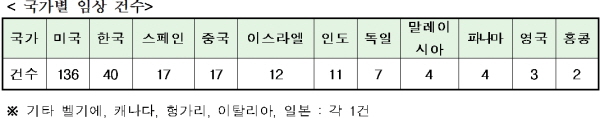
미국의 개발단계별 임상연구 현황은 제1상에서 제3상까지 고른 분포를 보였다. 국내도 미국과 유사한 양상이었다. 스페인은 I상에 비해 I/II상의 비율이 높고, II/III상에 비해 III상의 비율이 높은 것으로 나타났지만 각 단계별 연구 건수는 한국이 스페인을 앞질렀다. 중국은 94%가 임상 1~1/2상에 머무르는 수준이었다.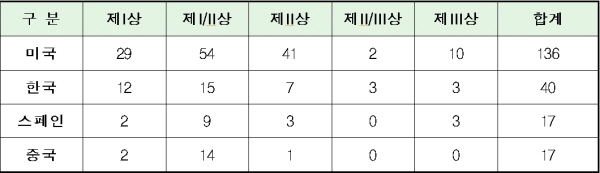
임상연구에 사용된 세포 종류는 전체 258건중 70%인 182건이 안전성 및 윤리적 이슈가 적은 중간엽 줄기세포다. 조혈모세포(12%, 29건), 신경줄기세포(4%, 10건)가 뒤를 이었다.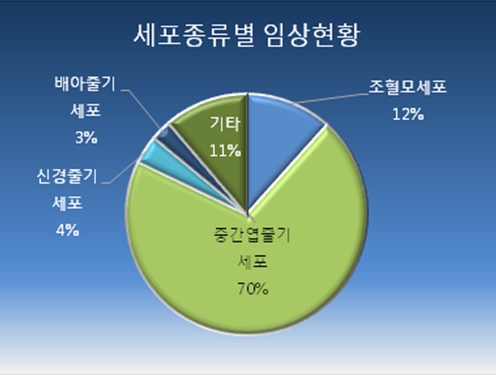
세포의 기원별 조사에서는 골수가 가장 많은 44%(114건), 지방조직이 20%(53건), 제대혈이 13%(33건) 순으로 나타났다.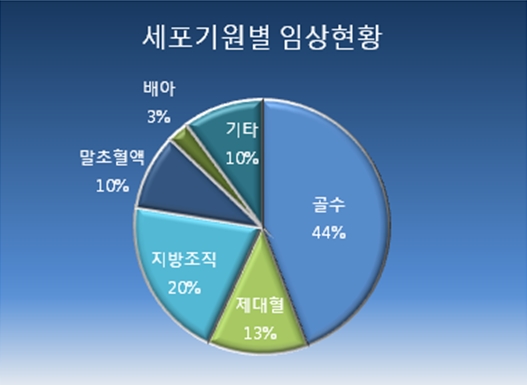
질환군별 임상연구 진행 현황은 심혈관계(69건), 신경계질환(41건), 정형외과질환(32건)으로 조사됐다. 가장 많은 임상연구가 진행중인 심혈관계는 제I/II상과 제II상이 각 23건, 제III상은 6건이었다. 신경계질환은 제I/II상이 18건이며, 임상연구의 마지막 단계인 제III상에는 심혈관계와 소화기계가 각 6건의 임상연구가 진행중인 것으로 나타났다.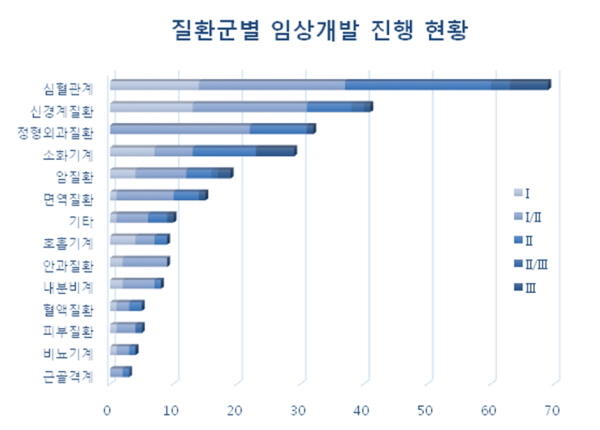
식약처 관계자는 “이번 동향보고서를 통해 국내·외 줄기세포치료제 연구 관련 정보를 정확하고 신속하게 제공해 국내 연구개발에 도움이 되기를 기대한다”며 “동향보고서를 향후에도 지속적으로 제공할 계획”이라고 말했다.

