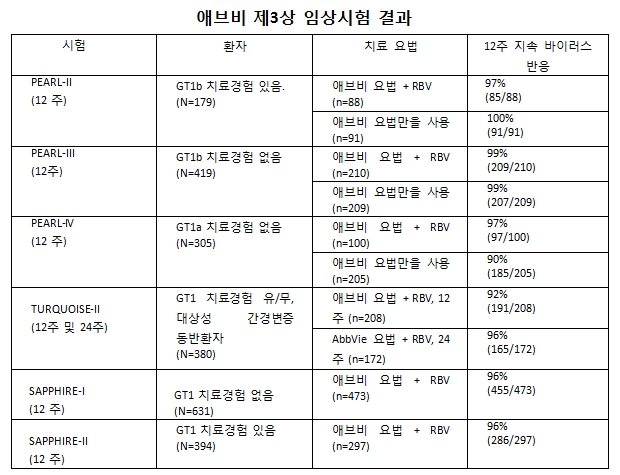
신약후보물질에 리바비린(RBV)을 추가 혹은 추가하지 않는 애브비요법의 유효성 및 안전성이 입증됐다. 애브비가 실시한 4건의 임상시험 결과 유전자 1형(GT1) C형간염바이러스(HCV) 감염 환자의 99%가 리바비린 추가 여부에 관계없이 12주간 ‘지속 바이러스 반응(SVR12)’을 보였다. 또 치료가 어려운 간경변성 환자의 92~96%에서도 SVR12를 나타냈다.
애브비는 HCV 감염 환자를 대상으로 애브비요법의 안전성 및 유효성을 평가한 제3상 임상시험을 완료하고 4건의 추가 연구결과를 10일 발표했다. 애브비요법은 신약후보물질인 ABT-267(25㎎) 및 ABT-450/리토나비어(150/100㎎) 복합제(1일 1회 투여)와 ABT-333(1일 2회, 250㎎)에 리바비린(1일 2회 체중에 따라 투여)을 추가하거나 추가하지 않는 치료법이다. 서로 다른 세가지 기전의 약물이 복합돼 C형간염바이러스(HCV) 복제 과정을 억제하고, 다양한 환자군에서 SVR 비율을 최적화한다.
이 치료법은 지난해 5월 미국 식품의약국(FDA)으로부터 혁신치료제(Breakthrough Therapy)로 선정됐다. 애브비는 올 2분기에 주요 허가신청을 제출할 계획이다.
스콧 브런(Scott Brun) 애브비 제약개발 부사장은 “25개국 환자 2300명이 참여한 이번 대규모 제3상 임상시험 결과는 대상성 간경변증 환자를 포함한 C형간염바이러스 감염군를 대상으로 애브비요법이 어떻게 작용하는지를 보여준다”며 “애브비 요법은 반응률과 내약성이 높고 치료 중단율은 낮다”고 설명했다.
애브비는 향후 학회 및 저널을 통해 상세한 연구결과를 발표할 예정이다.
M13-389(PEARL-II) 연구는 C형간염바이러스에 감염된 환자 중 치료경험이 있고 간경변이 없는 성인을 대상으로 12주 동안 애브비요법의 유효성 및 안전성을 비교했다. 79명의 임상 대상자 중 91명은 리바비린 비(非)투여군에, 나머지 88명은 리바비린 추가 치료군에 배정돼 12주간 치료받았다. 리바비린을 투여하지 않은 환자는 모두 SVR12에 도달했고, 리바비린 추가 투여군은 97%가 SVR12에 도달했다.
가장 흔하게 보고된 이상반응은 피로감과 두통이었다. 이로 인한 치료 중단은 리바비린을 투여하지 않은 환자군에서는 없었다. 리바비린 추가 투여군에서는 2명(2%)이 발생했다. 바이러스 재발 혹은 바이러스 돌파현상은 두 환자군 모두 나타나지 않았다.
M13-961(PEARL-III) 연구는 C형간염바이러스에 감염된 환자 중 치료 경험과 간경변이 없는 성인 환자를 대상으로 12주 동안 애브비요법에 대한 리바비린 추가군과 비추가군의 유효성 및 안전성을 비교했다.
419명 중 209명은 무작위로 애브비요법에 리바비린을 추가하지 않는 치료군에, 나머지 210명은 무작위로 리바비린 추가 치료군에 배정돼 12주간 치료받았다. 리바비린을 추가하지 않은 환자군의 99%, 리바비린 추가 투여군의 99%가 SVR12에 도달했다.
가장 흔하게 보고된 이상반응은 두통과 피로감이었다. 이상반응으로 인한 치료 중단은 없었다. 바이러스 재발 혹은 바이러스 돌파현상은 리바비린을 추가하지 않은 환자군에서는 없었다. 리바비린 추가 투여군에서는 0.5%에서 이상반응이 나타났다.
M14-002 (PEARL-IV)연구는 C형간염바이러스에 감염된 환자 중 치료 경험과 간경변이 없는 성인 환자를 대상으로 12주 동안 애브비요법에 대한 리바비린 추가군과 비추가군 유효성 및 안전성을 비교했다.
전체 임상 참가자 309명 중205명은 무작위로 리바비린을 추가하지 않는 치료군에 배정돼 12주간 치료를 받았다. 나머지 100명은 12주 동안 무작위로 리바비린 추가 치료군에 배정돼 치료받았다. 12주 후 리바비린을 추가하지 않은 환자들은 90%가 SVR12에 도달했다. 리바비린 추가 투여군은 97%가 SVR12에 도달했다.
가장 흔하게 보고된 이상반응은 피로감, 두통, 메스꺼움이었다. 이상반응으로 인한 치료 중단은 리바비린을 투여하지 않은 환자군에서 2명(1%), 리바비린 추가 투여군에서는 발생하지 않았다. 바이러스 재발 혹은 바이러스 돌파현상은 리바비린을 추가하지 않은 환자군에서 8%, 리바비린 추가 투여군에서 2%의 발생률을 보였다.
M13-099 (TURQUOISE-II)연구는 GT1 간경변증 동반환자만을 대상으로 인터페론을 포함하지 않는 경구요법을 평가했다. 치료경험이 있거나 없는 GT1a 및 GT1b HCV에 감염된 간경변성 성인환자를 대상으로 애브비요법에 리바비린을 추가 투여해 12주 또는 24주에 유효성과 안전성을 평가한 글로벌, 다기관, 무작위 배정, 공개연구다.
치료 경험이 있거나 없는 GT1a 및 GT1b 대상성 간경변증 환자 380명이 연구에 참가했다. 이중 208명은 무작위로 애브비요법에 리바비린을 추가한 치료군에 배정돼 12주간 치료를 받았다. 172명은 무작위로 애브비 요법에 리바비린을 추가 투여해 24주간 치료받았다. 12주 치료 후 92%가 SVR12에 도달했다. 24주 치료 후 96%가 SVR12에 도달했다.
가장 흔하게 보고된 이상반응은 피로감, 두통, 메스꺼움이었다. 이상반응으로 인한 치료 중단은 12주간 애브비요법에 리바비린을 추가 투여한 환자군에서는 4명(2%), 24주간 애브비요법에 리바비린을 추가 투여한 환자군에서는 4명(2%)이 발생했다. 바이러스 재발 혹은 바이러스 돌파현상은 12주간 치료를 받은 환자군에서는 6%, 24주간 받은 환자군에서는 2%에서 나타났다.