 유방암치료제 ‘허셉틴’의 세계 최초 바이오시밀러의약품인 셀트리온의 ‘허쥬마’
유방암치료제 ‘허셉틴’의 세계 최초 바이오시밀러의약품인 셀트리온의 ‘허쥬마’
바이오시밀러(biosimilar)는 이미 품목허가를 받은 바이오의약품과 품질·비임상·임상시험에서 동등성을 입증한 의약품이다. 허쥬마는 허셉틴을 모방한 세계 최초의 바이오시밀러다. 국내서는 2012년 허가받은 ‘램시마(성분명 인플릭시맵, infliximab)’에 이은 두번째 바이오시밀러다.
바이오시밀러는 고가의 오리지널 바이오의약품보다 상대적으로 낮은 가격에 공급할 수 있다. 2006년 유럽연합(EU)이 성장호르몬 바이오시밀러 의약품을 최초로 허가한 뒤 미국, 일본 등에서 앞다퉈 개발하고 있다.
세계 최초로 항체를 이용한 바이오시밀러로 허가받은 램시마는 지난해 유럽연합(EU)의 승인을 얻어 식약처 심사체계의 우수성을 전세계에 알렸다. 같은해 11월에는 국제기여도와 허가·심사 경험을 높이 평가받아 국제규제조화회의(ICH, 허가·심사관리 국제조화 가이드라인 마련을 위한 미국, 일본, EU의 의약품 규제당국 및 제약단체 협의체)의 의약품 규제당국자 포럼(IPRF)에서 한국이 비회원국 최초로 바이오시밀러 규제조화 국제 위킹그룹 의장국으로 선출됐다.
식약처는 2009년부터 첨단 바이오의약품을 신속히 제품화하기 위해 개발 초기부터 허가·승인 업무를 총괄·조정하는 프로젝트매니저(PM)제도, 허가심사 자료를 사전에 상담하거나 검토해주는 사전검토 제도, 전문적 심사를 강화하는 기능별 심사 등을 도입했다. 지난해에는 ‘2017년 7대 바이오의약품 강국’을 목표로 한 글로벌 바이오의약품 지원 방안을 마련했다.
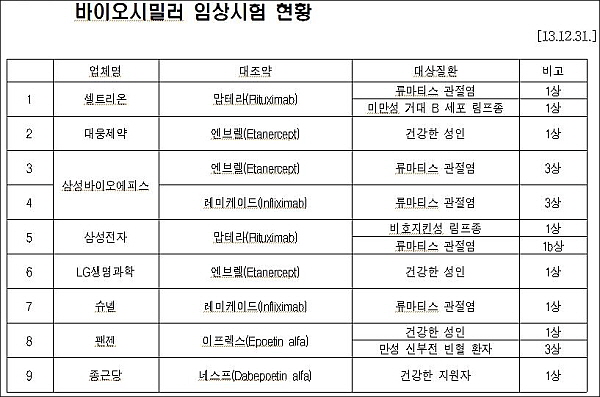 국내 바이오시밀러 임상시험 현황
국내 바이오시밀러 임상시험 현황

