- 2005년부터 허가받은 아시도필루스 대신 도퍼맨텀·델브뤼키균으로 제조하고도 변경신고 안해
 동화약품의 유산균제제 ‘락테올’ 캡슐
동화약품의 유산균제제 ‘락테올’ 캡슐
동화약품이 2005년부터 8년간 유산균제제 ‘락테올(성분명 틴달화 락토바실루스아시도필루스, Lactobacillus acidophilus)’ 제조 시 정부당국의 허가사항과 다른 유산균주를 사용해 온 것으로 나타났다.
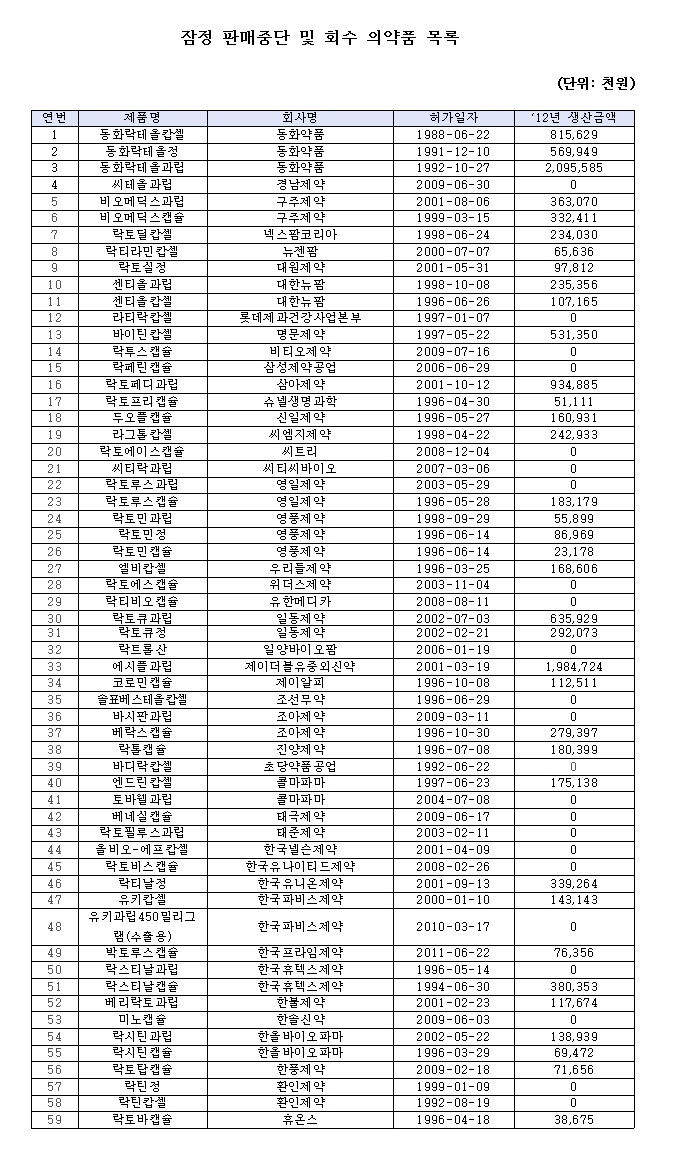
식품의약품안전처는 동화약품의 유산균제제인 락테올캡슐·락테올정·락테올과립 등 3개 품목과 56개의 제네릭 제품을 잠정 판매 중지 및 회수조치하고 유효성 평가를 위한 특별재평가를 실시한다고 8일 밝혔다. 이번 평가는 급성설사치료제로 허가된 락테올 제조 시 사용한 유산균 성분이 허가 당시 등록했던 성분정보와 다른 것으로 확인된 데 따른 것이다.
식약처에 따르면 이 회사는 1988년 락테올 허가신청 당시 락토바실루스아시도필루스 유산규으로 제품을 제조한다고 보고했다. 그러나 2005년부터는 같은 락토바실루스 속(屬)이지만 종(種)이 다른 퍼멘텀(fermentum)·델브뤼키(delbrueckii)균 혼합물을 사용해 온 것으로 나타났다. 또 해당 유산균(L. acidophilus)은 안전성에는 문제가 없으나 정부로부터 허가받은 급성설사에 대한 효능·효과가 충분히 입증되지 않은 것으로 밝혀졌다.
특별 재평가는 허가진입 과정에서 정당한 절차를 거쳤으나 이후 새롭게 확인된 안전정보를 다시 평가하는 것으로, 평가를 먼저 진행한 후 결과에 따라 적절한 조치를 취하는 게 일반적이다. 그러나 이번 사례는 진입과정에서 적정한 평가를 받지 못한 것으로 판단됨에 따라 먼저 잠정적인 판매중단 조치를 취한 후 평가결과를 반영하는 방식으로 진행됐다.
특히 동화약품은 2005년 원료(유산균)의 규격 변경 등을 프랑스 원개발사로부터 통보받았으나 식약처에 변경신고 절차를 진행하지 않은 것으로 나타났다. 이에 따라 식약처는 허가변경신고를 하지 않은 이 회사를 고발조치하고 해당 품목에 대해서는 제조업무정지 6개월의 행정처분을 내릴 방침이다.
이에 따라 제네릭 제품도 급성설사에 대한 효과가 충분히 입증되지 못한 것으로 판단돼 잠정 판매중단 및 회수된다. 현재 허가된 44개사 56개 제품 중 32개 제품이 생산·판매 중이다.
이번 특별재평가에서는 프랑스 원개발사의 허가자료 및 품질검사 등을 조사·평가하며, 결과에 따른 후속조치는 중앙약사심의위원회 자문을 거쳐 이르면 2013년 10월말 내로 실시될 예정이다.
제네릭 의약품의 경우 ‘민·관 특별재평가팀’이 문헌조사와 비임상·임상시험을 함께 진행한 후 효능 조정 및 판매재개 허용 등 후속조치를 취할 계획이다. 급성설사 등 효능·효과에 대한 문헌조사는 오는 10월말까지, 임상시험은 2014년 7월까지 실시된다.
식약처는 유산균제제에 대한 관리를 강화하기 위해 허가신청 시 유산균의 균종 입증자료 등을 제출토록 하는 ‘의약품의 품목허가·신고·심사규정’을 개정할 방침이다. 또 모든 유산균종에 대해 확인시험법(PCR, 중합효소연쇄반응)을 추가 실시해 정기적으로 유산균종을 확인할 수 있는 시스템을 구축할 계획이다.
이와 함께 국내·외 허가사항을 5년마다 평가하는 주기적 품목갱신제를 운영할 예정이며, 2015년에는 의약품실사 상호협력기구(PIC/S)에 가입함으로써 제조공정 변경정보에 대한 상호교환 시스템을 구축하게 된다.
유무영 의약품안전국장은 “락테올과 제네릭제품의 반품이 원활하게 진행되도록 약사회, 제약협회, 도매협회, 제약사 등 협조를 요청할 계획”이라며 “급성설사 증상으로 해당 제네릭 제품을 복용하던 환자는 의·약사와 상담 후 일반 지사제나 다른 유산균제제를 복용하면 된다”고 설명했다. 이어 “건강보험심사평가원에 해당 의약품 목록을 통보함으로써 병원이나 약국에서 처방·조제가 이뤄지지 않도록 조치했다”고 말했다.
 동화약품의 유산균제제 ‘락테올’ 캡슐
동화약품의 유산균제제 ‘락테올’ 캡슐

