- 차바이오앤디오스텍 국내 임상신청계획 … 스타가르트병 등 희귀병은 이미 임상시험 진행 중
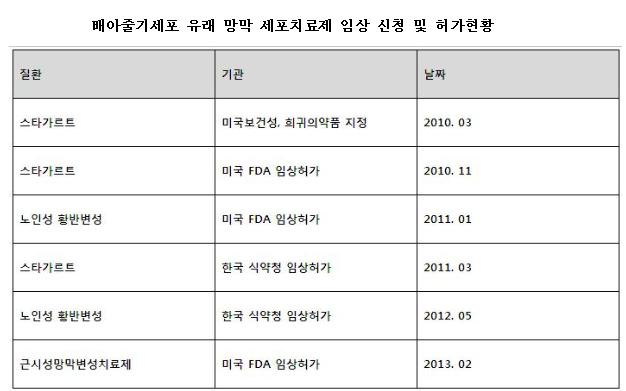
차바이오앤디오스텍과 미국 협력사인 ACT(Advanced Cell Technology)가 공동 연구·개발한 ‘배아줄기세포 유래 근시성망막변성치료제’가 미국 식품의약국(FDA)의 임상시험 승인을 받아 국내에서의 임상시험 신청도 탄력을 받을 전망이다. ACT사는 ‘배아줄기세포 유래 망막색소상피세포’를 이용한 근시성망막변성치료에 대해 지난 2월 FDA의 임상승인을 받았다고 11일 밝혔다.
근시성망막변성이란 근시가 심한 사람에게 간혹 나타나는 비정상적인 망막의 변화로 시신경과 황반 주위의 맥락막 혈관 퇴행이 주된 요인이다. 국내에 2만8000여명의 환자가 있는 것으로 추정되며 치료 방법은 없다. ACT사는 30세 이상의 근시성망막변성환자 12명을 대상으로 안전성과 내약성을 평가하는 임상시험을 미국 캘리포니아주립대 로스엔젤레스(UCLA)의 줄스스타인눈연구소(Jules Stein Eye Institute)에서 진행하게 된다.
차바이오앤디오스텍도 이 치료제에 대한 임상시험을 식품의약품안전청에 신청할 예정이다. 양사 공동 연구개발의 성과인 이 치료제는 희귀질환인 스타가르트병와 노인성망막변성에 대한 FDA와 식약청의 임상승인을 받고 시험 중에 있으며, 세번째 적응증으로 근시성 망막변성에 대한 임상시험을 추진 중이다.
이밖에 차바이오앤디오스택은 지난해 5월 배아줄기세포를 이용한 망막치료제로 ‘위축성 나이관련 황반변성’ 환자에 대한 첫 시술을 지난해 11월 성공적으로 마쳤다. 아울러 독립자료모니터링위원회로부터 안전성 자료를 검토한 결과 임상시험의 지속 승인을 통보받아 현재 두 번째 환자에 대한 시술을 준비하고 있다.
양 사는 2010년 3월 이번 배아줄기세포 유래 근시성망막변성치료제로 미국 보건성(US Department of Health and Human Service)으로부터 스타가르트병에 대한 희귀의약품(Orphan Drug)으로 지정받은 바 있다. 이를 통해 세금공제, 임상시험을 위한 자금지원 획득 기회, FDA 승인 가속화, 약품승인에 대한 최대 7년 동안의 마케팅 독점 허락 등 다양한 기회와 혜택을 누릴 수 있어 향후 빠른 임상시험 전개에 도움이 될 전망이다.