세계 최초의 고리형 아데노신 일인산(cAMP) 편향 글루카곤 유사 펩타이드-1(GLP-1) 수용체 작용제가 2형 당뇨병 치료제로 중국에서 시판 승인을 받았다.
중국 대사질환 치료제 발굴‧개발 전문기업 사이윈드바이오사이언스(Sciwind Biosciences‧杭州先爲達生物科技)는 성인 2형 당뇨병 환자들의 혈당 조절 개선제 에크노글루타이드(ecnoglutide) 주사제가 중국 국가약품감독관리국(NMPA)의 허가를 취득했다고 지난달 30일 발표했다.
특히 에크노글루타이드는 국내 HK이노엔이 2024년 사이윈드로부터 도입한 신약후보물질(개발코드명 IN-B00009)로 2025년 5월 식품의약품안전처로부터 3상 임상시험계획(IND)을 승인받았으며 지난달 20일 3상 대상자(313명) 모집을 완료했다. 40주에 걸친 투약이 연내에 완료되면 내년 상반기에 승인신청이 제출될 것으로 전망된다.
국내 3상은 강북삼성병원을 포함한 총 24개 의료기관에서 당뇨병을 동반하지 않은 국내 성인 비만 또는 과체중 환자를 대상으로 진행된다. IN-B00009 또는 위약을 주 1회 피하주사로 투여하며 유효성과 안전성을 평가한다. 1차 평가지표(primary endpoint)는 기저치 대비 40주 시점의 체중 변화율과 체중 감소율 5% 이상인 사람의 비율이다.
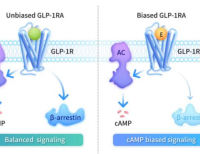
에크노글루타이드는 세계 최초의 cAMP 편향 GLP-1 수용체 작용제로 기록됐다고 사이윈드 측은 의미를 부여했다. 기존의 비 편향(unbiased, 또는 balanced) GLP-1 수용체 치료제들과 달리 cAMP 편향성(biased) 수용체 작용제는 cAMP의 신호전달 경로를 선택적으로 활성화시키는 반면 베타-아레스틴 동원(β-arrestin recruitment)은 최소화할 수 있는 게 장점이다. 이같은 신호전달 편향은 GLP-1 수용체에 대한 약물의 탈감작(약물반응 저하)을 약화시키고, 세포 표면에서 수용체 발현을 보존하면서 치료적 신호전달을 지속적으로 연장시켜 줄 수 있다고 사이윈드는 설명이다. 이같은 차별화된 기전은 치료 효능을 향상시키면서 대사계 유익성(인슐린 분비 유도, 글루카곤 분비 억제, 위 배출시간 지연)을 유지시켜준다고 강조했다.
β-아레스틴은 G-단백질 결합 수용체(GPCR)를 AP2 어댑터 단백질(adaptor protein), 클라트린(clathrin), 다이나민(dynamin)과 같은 수용체 이동에 관여하는 단백질과 물리적으로 연결시키는 역할을 한다. 아레스틴은 많은 GPCR의 탈감작에 중요한 역할을 하는 신호전달 스캐폴드 단백질이다. 아레스틴은 활성화된 GPCR에 결합하기 위해 세포질에서 세포막으로 이동함으로써 수용체 탈감작을 개시하는 역할을 한다.
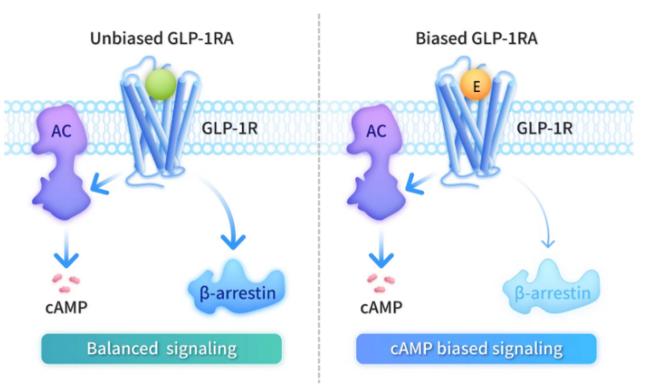 cAMP 편향성 GLP-1 수용체 작용제의 이점. 출처 중국 사이윈드바이오사이언스 홈페이지
cAMP 편향성 GLP-1 수용체 작용제의 이점. 출처 중국 사이윈드바이오사이언스 홈페이지
NMPA는 3상 ‘EECOH-1’ 및 ‘EECOH-2’ 임상시험에서 도출된 결과를 근거로 에크노글루타이드 피하주사제를 승인했다.
두 임상은 중국 내 2형 당뇨병 환자들을 대상으로 각각 에크노글루타이드 단독요법 또는 에크노글루타이드+메트포르민 병용요법의 유효성‧안전성을 평가했다. 두 임상에서 효과적인 혈당 조절뿐만 아니라 유의할 만한 수준의 체중감소, 핵심적인 대사계 매개변수들의 개선 등의 효능이 52주 동안 유지됐다. 안전성‧내약성 프로필도 호의적이었다.
이 중 ‘EECOH-1’ 임상은 식이요법과 운동만으로 혈당을 충분한 수준으로 조절하지 못한 성인 2형 당뇨병 환자에게 2가지 용량(0.6mg, 1.2mg)의 에크노글루타이드를 투여했다.
그 결과 24주 후 평가했을 때 플라시보 대조그룹에 비해 당화혈색소 수치가 견고하게 감소한 것으로 나타났다. 에크노글루타이드 0.6mg, 1.2mg 용량을 투여한 경우 당화혈색소 수치가 각각 1.96%p. 2.43%p 감소했다. 반면 위약군은 1.09% 감소에 그쳤다.
위약군과 비교하면 에크노글루타이드 2개 용량 투여군은 24주차에 당화혈색소 수치가 5.7% 상회, 6.5% 상회, 7.0% 상회 비율이 유의할 만하게 높았다. 에크노글루타이드 1.2mg 투여군은 피험자의 80.3%가 당화혈색소 수치 7.0%를 밑도는 것으로 집계됐다. 아울러 용량의존적으로 당화혈색소 수치 조절목표 6.5% 미만 및 7.0% 미만에 도달한 비율이 에크노글루타이드가 위약군 대비 유의하게 높았다.
‘EECOH-2’ 임상은 메트포르민으로 혈당을 충분한 수준으로 조절하지 못한 성인 2형 당뇨병 환자들이 피험자를 대상으로 에크노글루타이드 0.6mg 또는 1.2mg, 또는 ‘트루리시티’(둘라글루타이드) 1.5mg을 각각 투여받았다.
그 결과 에크노글루타이드 투여군은 당화혈색소 수치가 더 유의하게 감소했다. 32주차에 에크노글루타이드 0.6mg 투여군은 당화혈색소 수치가 평균 1.91% 감소했다. 1.2mg 투여군은 1.89% 감소, 둘라글루타이드 투여군은 1.65% 감소를 보였다.
52주차에 당화혈색소 수치가 7.0% 미만 또는 6.5% 미만에 도달한 비율은 에크노글루타이드 투여군이 트루리시티 투여군에 비해 유의할 만하게 높았다. 이 같은 효능은 52주까지 일관되게 유지됐다.
사이윈드바이오사이언스의 설립자인 하이 판(Hai Pan) 총경리는 “에크노글루타이드가 세계 최초의 cAMP 편향 GLP-1 수용체 작용제가 성공적으로 허가를 취득한 것은 중요한 이정표”라며 ““이번 성과를 바탕으로 과학·기술 혁신을 통해 치료 접근성을 넓히고, 중국은 물론 글로벌 환자에게 혜택을 제공하겠다”고 말했다.
중국의 당뇨병 환자 수는 지난 수 십년 동안 지속적인 상승세를 보여 2024년 현재 약 1억4800명선에 달한 것으로 추산된다. 중국 사이윈드바이오사이언스(위), 국내 HK이노엔 로고
중국 사이윈드바이오사이언스(위), 국내 HK이노엔 로고