 GC녹십자 로고
GC녹십자 로고
GC녹십자는 일본 의약품의료기기종합기구(PMDA)로부터 노벨파마와 공동 개발중인 산필리포증후군 A형(MPSIIIA) 치료제 ‘GC1130A’에 대한 1상 임상시험계획서(CTN, Clinical Trial Notification)를 승인 받았다고 12일 밝혔다.
지난 5월 미국 식품의약국(FDA)으로부터 임상 1상 IND 승인과 지난달 국내 IND 승인을 받은데 이어 이번 일본 PMDA승인으로 ‘GC1130A’의 다국가 임상 개발에 속도가 붙을 전망이다.
산필리포증후군(A형)은 유전자 결함으로 체내에 헤파란 황산염(Heparan sulfate)이 축적돼 점진적인 손상이 유발되는 열성 유전질환이다. 심각한 뇌손상이 주요 증상이며 대부분의 환자가 15세 전후에 사망에 이르게 되는 중증 희귀질환이다. 아직 허가 받은 치료제가 없기 때문에 환자들의 미충족 의료수요가 매우 크다.
GC1130A는 중추신경계에 투여할 수 있는 GC녹십자의 고농축 단백질 제제 기술을 산필리포증후군(A형) 치료제에 적용해 개발하고 있는 바이오혁신신약(First-in-Class)으로, 치료제를 뇌실 안에 직접 투여해 치료 효과를 높이는 방식이다.
이 방식(ICV, Intracerebroventricular injection)은 당사의 헌터증후군 치료제인 ‘헌터라제’에 적용돼 일본에서 품목허가를 획득한 바 있다.
또한 GC1130A는 주요 해외 의약품 규제기관으로부터 산필리포증후군(A형)에 대한 미충족 의료수요를 해결하기 위한 혁신 신약으로서 가능성을 인정받고 있다. 지난 2023년 미국(FDA)에서 희귀의약품(ODD) 및 소아희귀의약품(RPDD)으로 지정됐으며, 올해 들어 유럽(EMA)에서도 희귀의약품(ODD)으로 지정됐다.
이와 함께 지난 6월에는 FDA로부터 패스트트랙으로 지정(Fast Track Designation)받아 FDA와의 긴밀한 협의를 통해 보다 신속하게 신약을 개발할 수 있게 됐다.
GC녹십자 관계자는 "미충족 의료 수요가 큰 질환인 만큼, 산필리포증후군(A형)으로 고통받는 환자들에게 희망을 줄 수 있도록 신약 개발에 최선을 다하겠다”고 말했다.
 Gcare Lipid 제품 사진
Gcare Lipid 제품 사진
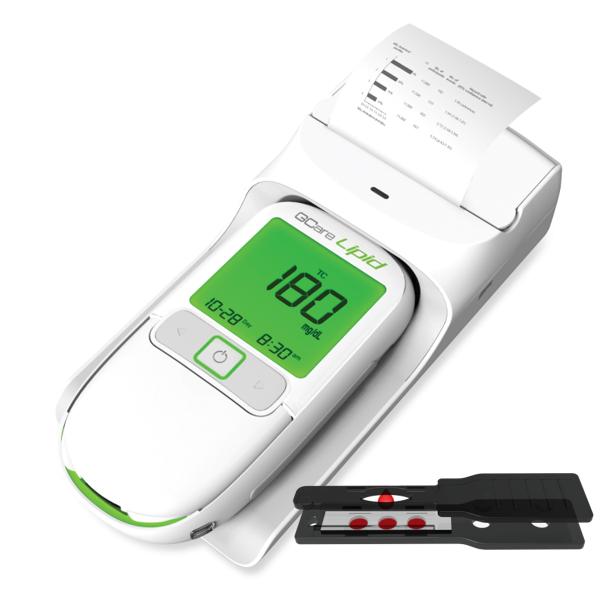
헬스케어 및 진단기기 전문기업 GC녹십자엠에스는 지난 9일 홍콩 의약품 전문 유통사 퍼스트링크 헬스케어 아시아(Firstlink Healthcare Asia Limited, 이하, 퍼스트링크)와 자사제품인 Gcare Lipid에 대한 수출계약을 체결했다고 12일 밝혔다.
Gcare Lipid 제품은 콜레스테롤 (총콜레스테롤, HDL: 고밀도 콜레스테롤, LDL: 저밀도 콜레스테롤) 및 혈당(Glucose), 요산(Uric Acid)을 측정할 수 있는 제품이다. 이번 계약은 Gcare Lipid 측정기 및 콜레스테롤, 혈당, 요산 측정 스트립, 그리고 결과지를 출력하는 프린터기 일체를 수출하는 계약으로, 향후 3년간 약 40억 원의 매출이 전망된다.
이번 계약을 체결한 퍼스트링크는 홍콩의 의료기기·의약품 전문 유통사로, 이 회사가 속한 제이콥슨 제약 그룹은 홍콩 내 의약품 시장의 40%를 점유하고 있으며, 전세계 15개국에 네트워크를 갖추고 있는 글로벌 기업이다. 제이콥슨 제약그룹의 지난 2023년 전체 매출액 4,500억 중 의약품 매출은 약 3,500억 원이다.
GC녹십자엠에스 관계자는 “이번 계약을 통해 당사 제품인 Gcare Lipid의 우수성을 입증했다”며 “GC녹십자엠에스는 중화권 내 당사 제품의 입지를 확고히 구축해 나가는 등 진단기기 내 시장점유율을 확대할 계획이다”고 밝혔다.
 GC셀 로고
GC셀 로고
지씨셀은 식품의약품안전처로부터 2024년 인체세포 등 관리업 및 세포처리시설 정기감시 실시 결과 적합판정 받았음을 12일 밝혔다.
국내에서는 '첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률'에 따라 모든 기관은 인체세포 또는 인체 유래 물질을 안전하고 적절하게 수집, 처리, 보관, 관리 등이 법적요구에 충족했음을 인증하는 인체세포 등 관리업 허가와 세포처리시설 허가를 받아야 한다.
뿐만 아니라, 지씨셀은 유럽 임상 물질 제공이 필요한 고객사 대응을 위해 유럽의약품청(EMA) EU GMP QP의 현상 실사 후 인증을 획득했다. 현재 국내 세포유전자치료제 CDMO기업 중 EU QP 실사 인증을 획득한 기업은 드물며, EU QP 인증은 유럽에서 임상시험 목적의 의약품 제조 및 수입에 필요한 필수 절차로, QP는 생산시설과 품질시스템이 EU GMP 기준을 충족하는지 감사한다.
지씨셀은 다수의 해외 제약사들의 실사를 통해 높은 수준의 생산시설과 기술력을 검증받았다. 해당 인증을 통해 지씨셀은 유럽의 임상 의약품 생산이 가능해지면서 유럽 시장 진출에 한발 더 다가서게 됐다.
지씨셀의 세포유전자치료제 연구개발생산시설인 셀센터는 연면적 20,806m2 규모로, 자가면역세포치료제인 이뮨셀엘씨주의 연간 최대 생산 규모는 18,000팩에 달한다. 셀센터는 최초 인체세포 등 관리업 허가를 득한 2021년도 이후 현재까지 총 2건의 현장감시 실시 결과 적합함을 확인받아, 첨단재생의료 및 첨단바이오의약품 개발과 생산에 필요한 요건을 충족하고 있다.
이를 통해 지속적으로 높은 수준의 품질 관리와 생산 능력을 유지함으로써 지씨셀은 글로벌 수준의 첨단바이오의약품 제조사일 뿐만 아니라 세포유전자치료제 위탁개발생산(CDMO)기업으로써 다시한번 입지를 강화했다.

