 SURMOUNT-1, 2 임상시험 주요 결과 한국릴리는 GIP(glucose-dependent insulinotropic polypeptide)/GLP-1(glucagon-like peptide-1) 이중효능제(dual agonist)인 ‘마운자로프리필드펜주’(Mounjaro, 성분명 티아제파타이드, Tirzepatide)가 7월 30일 만성 체중관리를 위한 보조제로 국내 식품의약품안전처 허가를 획득했다고 1일 밝혔다.
SURMOUNT-1, 2 임상시험 주요 결과 한국릴리는 GIP(glucose-dependent insulinotropic polypeptide)/GLP-1(glucagon-like peptide-1) 이중효능제(dual agonist)인 ‘마운자로프리필드펜주’(Mounjaro, 성분명 티아제파타이드, Tirzepatide)가 7월 30일 만성 체중관리를 위한 보조제로 국내 식품의약품안전처 허가를 획득했다고 1일 밝혔다.
마운자로는 최초이자 현재까지 유일한(2024년 7월 기준) GIP/GLP-1 이중효능제다. GIP, GLP-1은 인크레틴 호르몬의 일종으로 인슐린 분비 촉진, 인슐린 민감도 개선, 글루카곤 분비 감소, 식욕 조절, 포만감 유지 등에 영향을 미친다. 마운자로는 내인성 GIP 및 GLP-1의 표적인 GIP 수용체 및 GLP-1 수용체 모두에 선택적으로 결합해 활성화시킴으로써 식전·식후 혈당을 낮추고, 체중과 체지방량을 감소시킬 수 있다. 이에 비해 기존 비만 치료제의 강자인 노보노디스크의 ‘삭센다펜주’(Saxenda 성분명 리라글루타이드 liraglutide)와 ‘위고비프리필드펜’(Wegovy 성분명 세마글루아티드, semaglutide)는 GLP-1 수용체만 활성화한다.
마운자로(젭바운드)는 위고비와 함께 비만약의 시장의 ‘게임체인저’로 불리며 향후 10년간 양대 거대 의약품으로 자리잡을 것으로 예상되고 있다. 하지만 마운자로 국내 출시 시점은 불투명한 상황이다. 지난해 4월 국내에서 허가받은 위고비도 고질적인 글로벌 의약품 공급 부족으로 1년 넘게 국내에 출시하지 못하고 있다.
마운자로는 지난해 6월 국내서 당뇨병약으로 허가받은 데 이어 이번엔 비만약으로 치료 영역을 확장했다. 미국에서 마운자로는 2022년 5월 13일 FDA 승인을 받았고, 2023년 11월 8일 동일 성분 고함량 제제인 ‘젭바운드’가 비만 치료제로 허가받았다. 국내서는 당뇨약 및 비만약 브랜드가 모두 마운자로로 통일된다.
이번에 마운자로는 성인 환자의 만성 체중관리를 위해 저칼로리 식이요법 및 운동요법의 보조제로서 주 1회 투여하는 피하주사로 승인됐다. 투여 대상은 △초기 체질량지수(이하 BMI)가 30 kg/m² 이상인 비만 환자 △한 가지 이상의 체중 관련 동반질환(예, 고혈압, 이상지질혈증, 2형당뇨병, 폐쇄성 수면무호흡 또는 심혈관질환)이 있으면서 초기 BMI가 27 kg/m² 이상 30 kg/m² 미만인 과체중 환자다.
국내 성인 비만 및 복부비만 유병률은 최근 10년 간 지속적으로 증가했고, 특히 2단계(BMI 30이상, 35미만) 또는 3단계(BMI 35초과) 비만 유병률은 각각 1.6배, 2.9배로 더욱 가파르게 증가했다.
비만 환자는 건강한 성인 대비 네 개 이상의 동반질환이 발생할 위험이 12배 높고 77%가 정서적 웰빙 감소를 경험럼저, 비만 및 비만 관련 질환은 비전염성 질환으로 인한 사망의 주요 원인이다. 한국에서 비만으로 인해 발생한 사회경제적 손실은 연간 1조원에 달한다(2021년 기준).
마운자로의 만성 체중 관리 적응증은 SURMOUNT-1, SURMOUNT-2 두 개의 피험자 무작위 배정, 이중 맹검, 위약 대조 방식의 3상 결과를 기반으로 허가됐다.
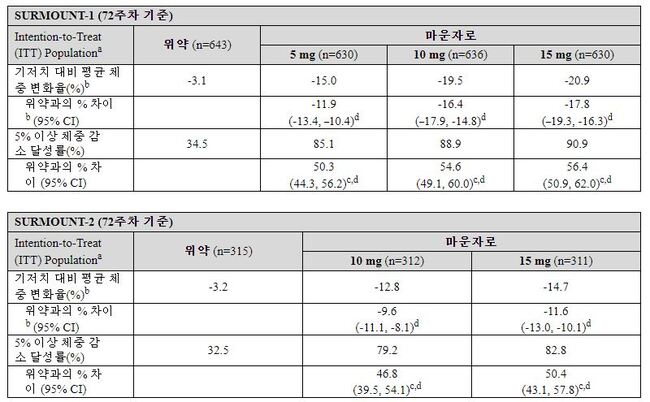
SURMOUNT-1은 비만(BMI≥30 kg/m²) 또는 2형 당뇨병을 제외한 한 가지 이상의 체중 관련 동반 질환(이상지질혈증, 고혈압, 폐쇄성 수면무호흡 또는 심혈관계질환)이 있는 과체중(27 kg/m²≤BMI<30 kg/m²) </span>성인 환자 2539명을 대상으로 72주간 진행된 임상시험이다.
SURMOUNT-2는 2형 당뇨병이 있는 BMI 27 kg/m² 이상 성인 환자 938명을 대상으로 72주간 진행됐다. 연구에 참여한 모든 환자는 임상시험 기간 동안 저칼로리 식이요법(하루당 약 500 kcal 저감) 및 운동요법(주당 최소 150분 권장)을 교육받았다. 두 연구의 1차 평가지표는 기저치 대비 72주차의 평균 체중 변화율(%) 및 5% 이상 체중감소 달성률(%)이었다.
연구 결과, 마운자로의 모든 용량은 위약 대비 통계적으로 유의한 체중 감량 결과를 나타냈다. 5% 이상 체중 감소 달성률은 마운자로 10mg, 15mg 투여군이 위약군 대비 높게 나타났다. 10%이상, 15%이상, 20%이상의 체중 감소 달성률도 더 높게 나타났다.
마운자로는 연령, 성별, 인종, 민족, 기저 BMI 수치, 혈당 상태와 관계없이 체중 감량 효과를 보였다. 마운자로의 안전성 프로파일은 2형 당뇨병 환자를 대상으로 한 이전의 임상시험 결과와 일관되게 나타났다. 가장 빈번하게 보고된 이상반응은 오심, 설사, 변비, 구토를 포함한 위장관장애 및 설포닐우레아와 메트포르민 및/또는 SGLT-2 억제제를 병용하거나 병용하지 않는 2형당뇨병 환자의 저혈당증이었다.
마운자로 약효는 기존 비만약 시장의 최강자인 노보노디스크의 ‘위고비’보다 뛰어나다는 평가다. 임상 3상 시험에서 평균 체중이 105㎏인 성인에게 마운자로 15㎎을 72주간 투여했더니 체중이 최대 22.5% 빠졌다. 84주 투여 임상시험에서는 체중이 평균 26.6% 줄었다. 위고비는 68주 투여 결과 15% 정도 감량 효과가 있는 것으로 보고됐다.
데이브 릭스 일라이릴리 최고경영자(CEO)는 올해 초 열린 세계 최대 제약·바이오산업 투자 행사 ‘2024 JP모건 헬스케어 콘퍼런스’에서 “지난해 12월 젭바운드가 주당 2만5000건의 신규 처방을 기록했다”며 “예상치를 초과하는 시장 수요 덕분에 올해 공급량이 충분하지 않을 수 있다”고 말했다. 릴리는 공급 문제를 해결하기 위해 미국, 유럽 등에 수십억달러를 투자해 연달아 공장을 증설 중이다.

