식품의약품안전처는 국내 백신 등에 대해 ‘WHO 사전 적격성 평가(PQ, Pre-qualification)’를 진행한 결과 (주)에스디의 말라리아 및 에이즈 바이러스(HIV) 진단제제 등 6개 제품(포장단위 별도)이 인증을 받았다고 20일 밝혔다.
6개 제품은 에이즈진단시약인 SD BIOLINE HIV Ag/Ab Combo (25T/kit, 30T/kit), SD BIOLINE-HIV 1/2 3.0(25T/kit, 30T/kit)과 말라리아 진단시약인 SD BIOLINE Malaria Ag P.f/Pan(25T/kit, 30T/kit) 등이다.
PQ인증은 국제보건기구(WHO)가 국제조달을 통해 개발도상국에 백신·진단제제 등 의약품을 공급하기 위해 안전성·유효성 등을 평가하는 제도다. 국제조달 입찰에 참여하기 위해서는 이 인증을 반드시 거쳐야 한다.
식약처는 이번 인증을 위해 지난 5월부터 ‘업체 맞춤형 상담서비스’를 구축해 정부 차원에서 체계적으로 지원하고 있다. 주요 지원 내용은 △임상·품질 등 신청 문서 작성법 △WHO 제조 및 품질관리 기준 실사 정보 및 사례 등이다.
국내서는 1996년 LG생명과학의 B형간염 백신 ‘유박스-비주’가 스타트를 끊은 이후 올해까지 총 21개 제품이 인증을 획득했다. 인증 제품의 수출액은 2006년 약 2000만달러에서 지난해 2억6000만달러로 크게 증가했다.
식약처는 앞으로도 국내 제약업체의 수출 경쟁력을 높이기 위해 기업활동 지원을 강화하는 등 ‘정부 3.0’ 구현에 앞장서겠다고 밝혔다. 현재 운영하고 있는 업체 맞춤형 상담 서비스도 지속적으로 운영하면서 내년부터는 WHO의 제조업소 실사 정보 및 사례 제공, 우수의약품제조품질관리기준(GMP) 모의실사 등 현장방문 기술지원 등을 추가로 수행할 예정이다.
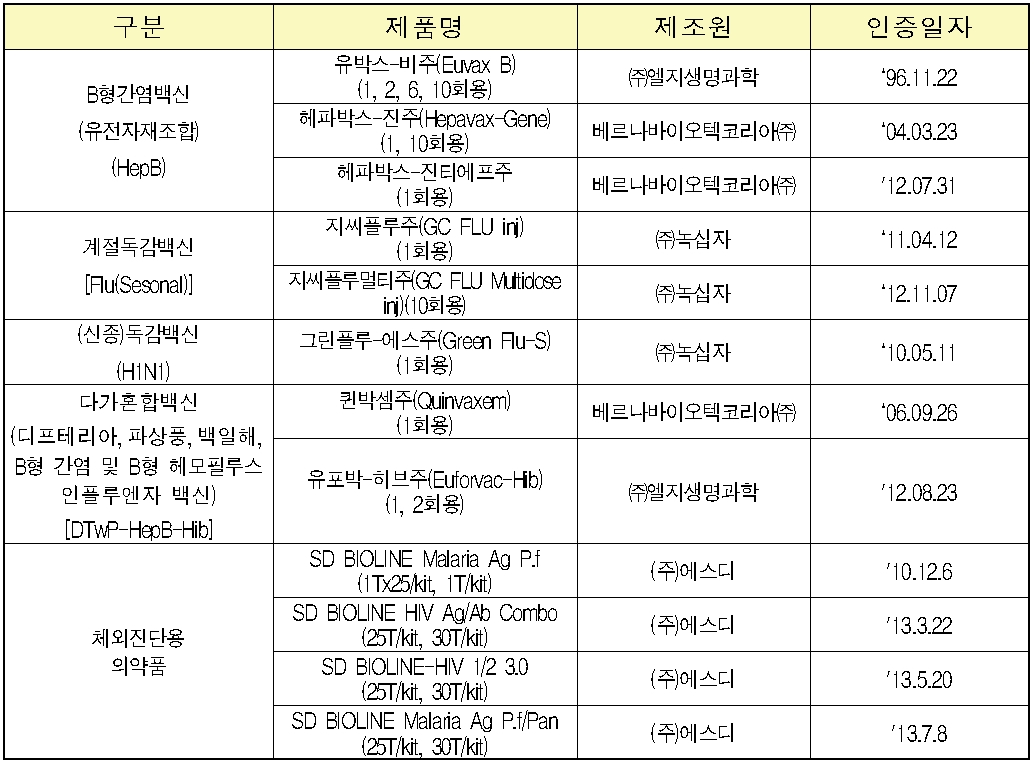 2013년 12월 현재 WHO 국내업체 인증 현황
2013년 12월 현재 WHO 국내업체 인증 현황

