식품의약품안전처가 간질치료제 ‘발프로산’ 제제를 편두통 예방을 목적으로 임부에게 사용하지 않도록 강조하는 안전성 서한을 8일 배포했다. 이번 조치는 미국 식품의약국(FDA) 권고에 따른 것이다.
FDA에 따르면 최근 발프로산 제제를 복용한 임부와 다른 성분의 항전간제를 복용한 임부에서 태어난 소아의 인지능력(IQ)을 비교한 결과 발프로산 제제를 복용했던 임부의 소아에서 인지능력 감소가 나타났다. 이에 따라 FDA는 편두통 예방을 목적으로 이 약제를 임부에게 사용하지 않도록 권고했다. 또 해당 제제의 편두통 예방 적응증과 관련해 FDA 약물 태아 위해성 분류(FDA Pregnancy Category) 등급을 기존 D등급에서 X등급으로 높일 예정이라고 발표했다.
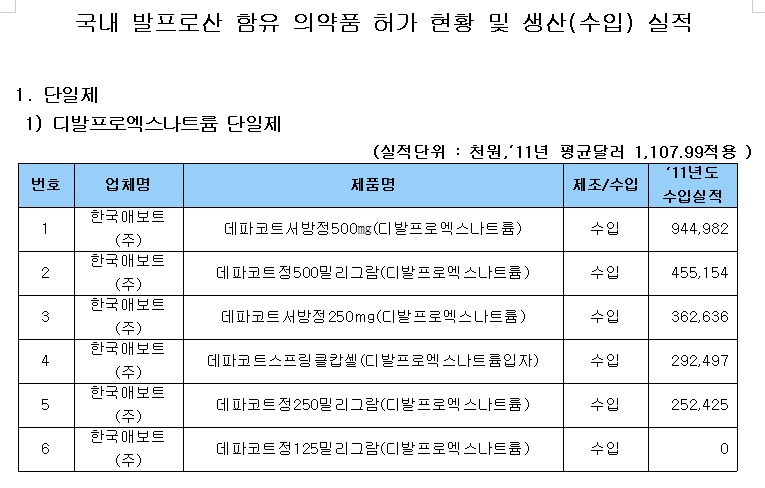
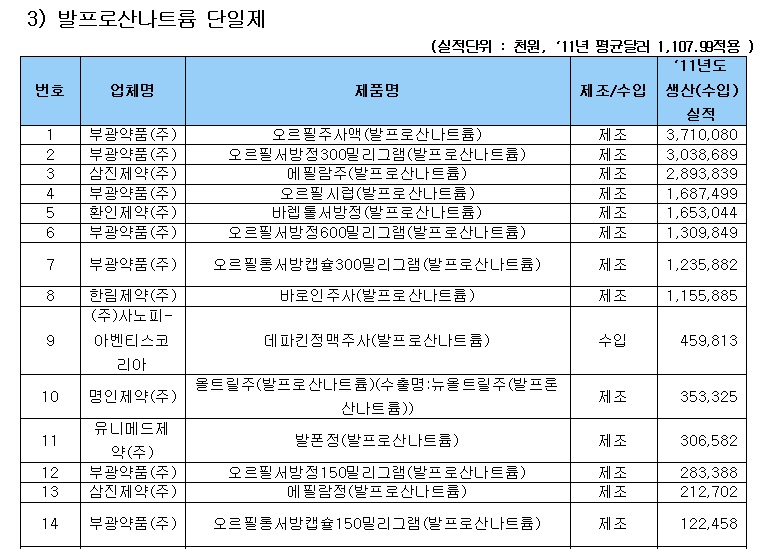
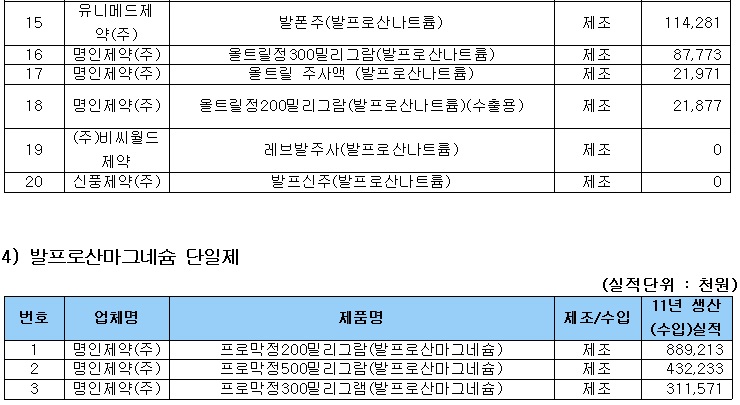
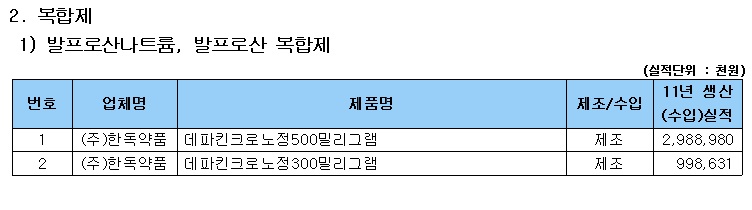
식약처 관계자는 “해당 약제의 안전성·유효성 전반에 대한 평가를 통해 허가사항 변경 등 필요한 조치를 취할 방침”이라며 “국내에는 사노피-아벤티스코리아의 ‘데파킨정맥주사’ 등 11개사 35품목이 허가돼 있는 상태며, 국내에 유통되는 발프로산 제제의 주의(허가)사항에는 ‘자궁 내에서 이 약에 노출된 소아의 낮은 인지검사 점수’ 등의 내용이 반영돼 있다”고 밝혔다.