서울대병원은 8일, ‘소아청소년 급성림프모구백혈병 대상 CAR-T 치료 임상연구’를 승인받았다. CAR-T 치료란, 환자 혈액에서 얻은 면역세포(T세포)가 암을 잘 인식할 수 있도록 유전자 조작을 거친 뒤, 배양해 다시 환자의 몸속에 집어넣는 치료법이다. 면역세포가 암세포만을 정확하게 표적하면서도 체내 정상세포 손상을 최소화해 획기적인 최신 치료법으로 주목받고 있다.
이번 승인은 임상연구계획을 제출한 지 약 8개월 만에 달성한 성과이다. 첨단재생바이오법이 시행되면서 서울대병원은 올해 4월, 백혈병 환아를 위한 ‘병원 생산 CAR-T 치료’ 임상연구계획을 제출했다. 보건복지부와 식품의약안전처 심의 후에 8일에 국내 최초로 고위험 첨단재생의료 임상연구 승인을 받았다.
재발성·불응성 소아청소년 급성림프모구백혈병 환자를 대상으로 본격적인 임상 연구에 나설 예정이며 환자에게 한줄기 희망이 될 것으로 기대된다. 기존 해외 CAR-T 치료제는 비용이 회당 5억 원에 달해 환자의 접근이 어려웠다. 서울대병원 임상연구가 공식적으로 승인됨에 따라, 환자들은 병원에서 생산한 CAR-T 치료제를 무상으로 공급받을 수 있다.
비용 뿐 아니라 속도 면에서도 우수하다. 기존 CAR-T 치료제는 환자의 T세포를 해외로 보내고, 증식해 다시 주입하기까지 평균 3주가 소요됐다. 이번 CAR-T는 병원에서 생산되기에 평균 12일로 획기적으로 단축된다. 시간을 다투는 급성림프모구백혈병 환아가 신속한 치료를 받을 수 있을 것으로 기대된다.
국내 병원이 자체적으로 CAR-T 치료제를 생산해 임상연구를 진행하는 것은 이번이 최초다. 기존에 없던 ‘1호’ 연구로서 복지부와 식약처의 까다로운 평가를 거쳤으며, 연구의 연구실시역량, 안전성, 유효성 등을 인정받았다.
해당 연구 책임자인 서울대병원 소아청소년과 강형진 교수는 “오랜 심의 끝에 연구계획을 승인받아 기쁘다”면서도 “국내 최초의 연구인만큼 오랜 심의를 거쳤고, 그사이 치료를 받지 못한 환아들에 대한 아쉬움이 남는다”고 밝혔다. 또한 “이번 연구가 비용 부담으로 CAR-T 치료를 받지 못한 국내 소아청소년 백혈병 환아들에게 희망이 되기를 기대한다”고 말했다.
한편, 해당 연구는 김효수 서울대병원 교수가 책임을 맡고 있는 서울대학교병원 연구중심병원 프로그램의 '바이오치료' 육성 유니트에서, 강형진 교수가 지난 4년간 준비한 연구이다.
서울대병원은 국내 연구자들이 개발한 CAR-T들이 환자들에게 쉽게 적용될 수 있도록 병원 자산을 활용하여 GMP생산-전임상시험-임상시험까지 한꺼번에 진행할 수 있는 ‘CAR-T 개발 원스톱 시스템’을 준비 중이며 이번 소아백혈병 CAR-T 치료제를 넘어 여러 질환에서 CAR-T 치료제 개발을 위해 노력할 예정이다.
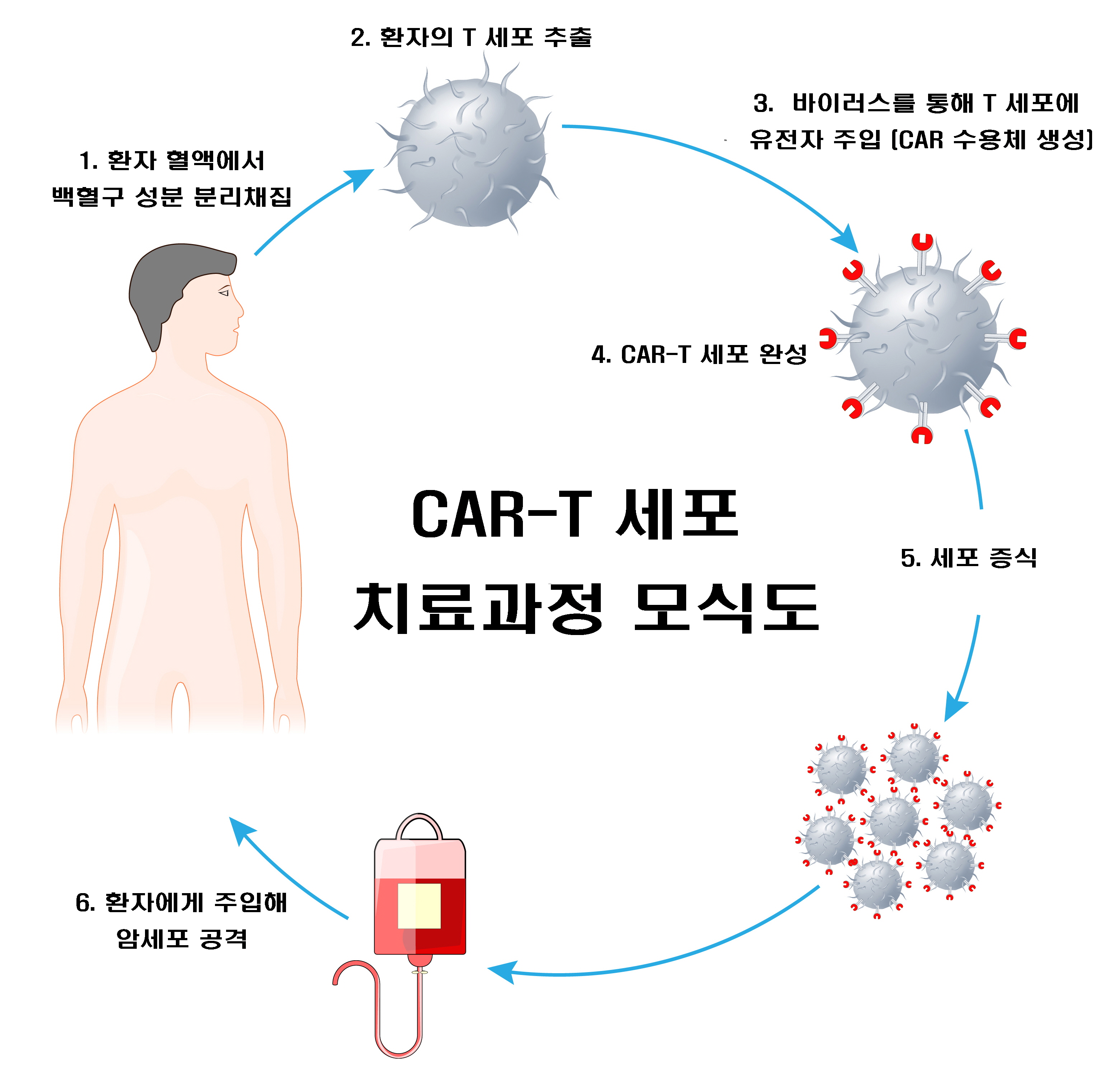 CAR-T 세포 치료과정 모식도. (서울대병원 제공)
CAR-T 세포 치료과정 모식도. (서울대병원 제공)

