미국 식품의약국(FDA)이 지난 6일엔 바이엘의 샤가스병(Chagas disease) 치료제인 ‘람핏’(Lampit 성분명 니푸르티목스 nifurtimox)을, 하루 뒤 7일엔 로슈의 척수성근위축증(spinal muscular atrophy, SMA) 치료제인 ‘에브리스디’(Evrysdi 성분명 리스디플람 risdiplam)와 미국 트리베나(Trevana)가 개발한 정맥주사용 아편유사제 ‘올린비크’(Olinvyk 성분명 올리세리딘 oliceridine)를 각각 승인했다. 8월 초순에 허가된 신약 3종을 개괄해본다.
키스벌레에 감염되는 샤가스병 박멸약 ‘람핏’
샤가스병(Chagas disease, American trypanosomiasis)은 브라질, 칠레, 아르헨티나, 우루과이 등 중남미의 열대풍토병으로 크루스 파동편모충(Trypanosoma cruzi) 감염에 의해 발생한다. 이 원충을 매개하는 곤충은 흡혈 침노린재류(Triatoma bug)이다. 침노린재는 입술이나 눈 주위를 주로 흡혈하므로 ‘키스 벌레’(kissing bug)라고도 한다. 샤가스병이 만성화되면 수년 후 심장비대(부정맥·심부전·실신·뇌혈전증 등 유발), 거대식도(흡인성 폐렴 유발), 거대대장(변비, 복통 유발) 등이 나타난다.
람핏은 익히 독일과 아르헨티나 등에서 승인됐으나 뒤늦게 이번에 미국에서 공식 승인됐다. 람핏은 18세 이하 아동에게만 처방돼야 한다. 체중에 따라 용량이 정해지면 식사와 함께 하루 3번 60일간 경구 투여하게 돼 있다. 임상시험 결과 60일 복용자의 32%에서 복용 후 1년간 혈중에 크루스 파동편모충의 항체가 생기는 것으로 나타났다.
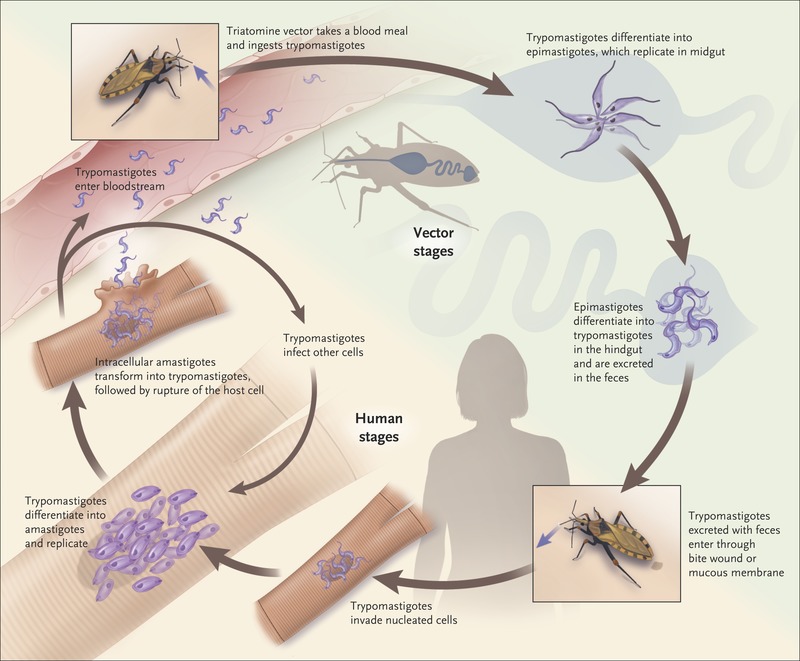 샤가스병의 감염경로. 출처=뉴잉글랜드저널오브메디신(NEJM)
샤가스병의 감염경로. 출처=뉴잉글랜드저널오브메디신(NEJM)
람핏은 가속승인에 의해 허가를 받았기 때문에 유효성을 추적 검증해야 한다. 람핏은 심각한 부작용으로 알레르기반응, 체중 감소가 나타났다. 흔하고 경미한 부작용으로는 구토, 복통, 두통, 식욕감퇴, 오심, 발열, 발진 등이었다.
3번째 SMA 치료제이자 첫번째 경구용약 ‘에브리스디’
로슈의 에브리스디는 바이오젠의 안티센스 올리고 뉴클레오티드(antisense oligonucleotide) 제제인 ‘스핀라자주(Spinraza 성분명 뉴시너센나트륨, Nusinersen)’와 노바티스의 유전자치료제인 ‘졸겐스마’(Zolgensma 성분명 오나셈노진 아베파보벡, Onasemnogene abeparvovec)에 이어 3번째로 출시됐다.
최초의 경구약(정제, 하루 한번) SMA 치료제인 리스디플람은 졸겐스마처럼 원샷으로 치료하는 유전자치료제보다는 못하지만, 요추천자로 척수에 주입하는 스핀라자에 비해서는 투여 편의상 비교 우위가 있다.
약가 면에서도 에브리스디는 연간 최대 34만달러로 책정했다. 일부 젊은 환자의 경우 10만달러 이하가 될 수 있다는 게 로슈의 설명이다. 반면 스핀라자는 첫해에 75만달러, 두번째 해 이후에는 연간 37만5000달러가 든다. 졸겐스마는 한번 투여로 끝나지만 212만5000달러라는 초고가로 혀를 내두르게 한다.
에브리스디는 광범위한 연령층을 대상으로 한 임상시험으로 승인받은 것도 장점으로 꼽힌다. 2~25세의 SMA 2형 또는 3형의 환자 180명을 대상으로 한 SUNFISH 임상결과에 따르면 1차 유효성 평가지표인 MFM-32(Motor Function Measure 32)로 운동기능을 측정했을 때 1년 후 리스디플람군은 1.36점 상승한 반면 위약군은 0.19 감소했다. 특히 2~5세 리스디플람군의 78.1%에서 MFM-32가 3점 이상 증가한 반면 위약은 52.9%에 불과했다. 18~25세 환자에서는 질병의 안정화 비율이 리스디플람군은 57.1%인 반면 위약군 37.5%에 그쳤다. MFM-32 척도는 신경학적 장애가 있는 환자를 대상으로 서서 걷기서부터 손과 손가락 사용까지 32가지 운동기능을 평가하는 지표다.
이와 함께 에브리스디는 주요 2차 평가변수인 상지기능검사(RULM, Revised Upper Limb Module)에서도 통계적으로 유의한 개선을 입증했다.
마약성 진통제 ‘올린비크’ 최단기간·최저용량 쓰도록 허가
정맥주사용 아편유사제(opioid)인 올린비크가 중등도 내지 중증 급성통증 환자에서 다른 치료 대안이 없을 때 투여할 수 있는 마약성 진통제로 승인받았다. 병원에서 최단기간 정맥주사로 맞게 되며 가정에서는 사용할 수 없다. 정해진 치료지침에 따라 최대한 짧게, 최저 용량으로 쓰도록 권고됐다.
올린비크는 주사 후 2~5분 만에 효과가 발생하며 신장 손상 환자에서도 용량 조정이 필요 없다. 임상시험에는 1535명의 환자가 참여했으며 부작용은 기존 아편유사제와 비슷한 것으로 나타났다.
최근 수년 새 오피오이드 오남용으로 해당 제약사들에 대한 대대적인 검찰수사가 진행되고 일부는 파산 위기에 몰린 가운데 이를 의식한 듯 FDA의 약물평가연구센터(CDER)의 규제담당 부국장인 더글라스 트록모톤(Douglas Throckmorton) 박사는 “오피오이드 의존성을 가진 환자와 감소와 신규 환자의 발생 감소를 위해 FDA가 최우선의 노력을 경주하고 있다”며 “위험성과 유익성을 혹독하게 검증한 결과 병원에서만 사용할 수 있도록 올린비크를 허가했다”고 설명했다.
이번 올린비크 승인으로 2018년 5월 9일 트리베나와 이 약의 한국내 개발 및 독점판매권을 획득하는 계약을 체결한 한국팜비오가 수혜를 입게 될 전망이다.

