난임 약물 주사치료는 GnRH 작용제 또는 GnRH 길항제로 조기 배란을 억제한다. 이어 LH, FSH, LH/FSH 복합제(HMG) 등으로 과배란을 유도한 다음 난포를 터지게 하는 난자성숙(또는 배란유도) 주사인 HCG 등을 투여하는 흐름으로 진행한다.
성선자극호르몬방출호르몬 작용제(GnRH agonist)
성선자극호르몬(gonadotropin, Gn, 생식선자극호르몬)은 뇌하수체 전엽에서 분비되는 당단백질 호르몬으로 FSH, LH, 태반/융모성성선자극호르몬(hCG) 등을 아우른다.
성선자극호르몬방출호르몬(gonadotropin release hormone, GnRH)은 뇌하수체 전엽에서 FSH, LH 등을 분비하도록 자극하는 호르몬이다.
GnRH 작용제는 성선자극호르몬방출호르몬의 수용체에 결합해 이것을 ‘탈감작’(desensitization)시킴으로써 결과적으로 성선자극호르몬이 작용하지 못하도록 억제하는 역할을 한다. 이를 통해 테스토스테론과 에스트로겐을 각각 거세 또는 불임 수준으로 낮춤으로써 전립선암, 유방암, 자궁내막증, 자궁근종, 성조숙증 등을 치료한다.
GnRH 작용제는 GnRH 유사체에 속하며 조기 배란을 방지한다. 류프로렐린(leuprorelin acetate: 상품명 루프린, 로렐린, 루프린디피에스, 루피어데포 등), 트립토렐린(triptorelin : 상품명 Decapeptyl), ‘신나렐 비강 스프레이’(Synarel, 성분명 nafarelin acetate), ‘졸라덱스데포주’(Zoladex, 성분명 goserelin acetate) 등이 있다.
류프로렐린의 경우 암 치료에서는 보통 1일 1회 1mg(0.2 mL)을 피하주사한다. 반면 체외수정을 위한 배란유도 목적으로는 14mg(2.8ml 들이 1 바이알)을 2주에 걸쳐 매일 한번 1mg을, 또는 매일 두 번 0.5mg씩 피하주사한다. 단독으로는 투여하지 않고 생식선자극호르몬(hMG, hCG, FSH)과 시차를 두고 또는 동시에 병용 투여한다.
류프로렐린은 ‘장기요법’에서 생식샘자극호르몬의 투여를 시작하기 최소 1주 전에, 즉 월경주기의 황체기 중반(월경 시작시점 기준 21~23일째, 또는 다음 생리주기 시작 5~7일 전, 또는 배란 후 7일경)에 1일 1 mg씩 투여한다. 이렇게 하면 류프로렐린 투여 후 7~10일간 새로운 LH 및 FSH의 생성이 억제된다. 이후 난포가 자극되기 시작하면 류프로렐린의 투여량을 반으로 줄이는 한편 생식선자극호르몬을 투여해 난포의 성장을 유도한다. 난포가 완전히 성숙되면 사람융모성생식샘자극호르몬(hCG)의 투여를 시작해 난자의 최종 방출(배란)을 유도한다. hCG 투여 직전에 류프로렐린 투여를 끊는다.
류프로렐린의 ‘단기요법’에서는 월경 주기 초반(생리 시작 2~3일째부터)에 생식선자극호르몬과 함께 동시에 류프로렐린을 투여하고, 난포가 완전히 성숙돼 hCG의 투여를 시작하기 직전에 류프로렐린의 투여를 중단한다.
트립토렐린(데카펩틸)은 보조적 배란 유도제로서 인간폐경생식선자극호르몬(hMG), 난포자극호르몬(FSH), 인간융모성 생식샘자극호르몬(hCG) 등과 병용한다. 황체기 중반부터 배란이 유도되기 전까지 트립토렐린아세트산염으로서 1일 1회 0.1mg을 매일 피하주사한다.
고세렐린(졸라덱스)의 경우 암치료에서는 4주에 1회 투여하지만, 보조생식술에서는 약효지속시간이 길어서 단회 투여한다. 투여 후 7~21일 지나면 뇌하수체가 억제된다. 이후 생식선자극호르몬(hMG, hCG, FSH)으로 배란을 촉진한다. 적당한 시기의 황체기에 성선자극호르몬을 중지하고 사람융모성생식샘자극호르몬(hCG)을 투여해 배란시킨다.
신나렐 비강스프레이는 시작 시점에 하루 두 번 분무한다. 이후 난소 자극이 개시되면 절반인 하루 한 번 분무로 줄인다. 적당한 시기의 황체기에 성선자극호르몬을 중지하고 사람융모성생식샘자극호르몬(hCG)을 투여하여 배란시킨다.
GnRH 작용제는 뇌하수체를 일시 억제하지만 일정 시간이 지나 생식선자극호르몬(내인성 FSH와 LH 등)이 급반등(갑작스런 방출)하면서 배란을 유발할 수 있다. 조기배란(premature ovulation)을 예방(억제)함으로써 양질의 배란을 유도하는 특성을 갖는다.
특히 GnRH 작용제를 이용한 down regulation(장기요법, long protocol, LP)은 과배란유도 과정에서 발생 가능한 조발성 황체화호르몬 급상승(premature LH surge)을 효과적으로 예방할 수 있을 뿐만 아니라 난포의 집단화 및 난포 성장의 동시성(synchronization)을 향상시킬 수 있다. 난자 회수(ovum pick-up, 인공수정을 위해 난소의 난포에서 난모세포(oocytes)를 흡인하는 과정) 일정 조절에 도움을 준다. 특히 난소과자극증후군((Ovarian hyperstimulation syndrome, OHSS, OHSS) 위험이 높은 다낭성난소증후군(PCOS) 환자에서 GnRH 작용제가 도움이 될 수 있다.
그러나 생식선자극호르몬의 급반등을 유도하기 위해(즉 뇌하수체의 GnRH 수용체의 탈감작을 위해) 2주 이상이 소요되는 단점이 있다. 이로 인해 환자의 13~20%에서 난소낭종이 발생할 위험이 초래되고, 경제적 비용이 증가하며, 환자의 정신적·신체적 부담이 가중되는 문제가 따른다. 이에 투여기간을 줄이고 작용기전이 직접적인 성선자극호르몬방출호르몬 길항제(GnRH antagonist)의 필요성이 제기됐다.
참고로 루프린디피에스11.25mg은 2주(3개월)마다 1회 투여하도록 작용시간을 늘린 장시간형 개량약이다. 22.5mg은 24주(6개월)마다 1회 투여한다. 반면 기본형인 3.75mg은 4주에 한 번 투여한다. 난임 치료용으로는 쓰지 않는다.
성선자극호르몬방출호르몬 길항제(GnRH antagonist)
GnRH 길항제는 직접 뇌하수체 전엽을 차단해 LH와 FSH의 분비를 막는 조기배란 방지 약물이다. 남성의 경우 고환이 테스토스테론을 만드는 것을 멈추게 한다. 여성에선 난소가 에스트로겐과 프로게스테론을 생성하는 것을 중단시킨다.
1세대는 효능이 낮고 히스타민 유리에 따른 알레르기반응 등 부작용으로 사실상 사용이 불가능했다. 이후 이런 문제를 개선한 3세대 GnRH 길항제가 등장했는데 독일 머크의 ‘세트로타이드주’(Cetrotide, cetrorelix acetate 0.265㎎, 0.25㎎ as cetrorelix)와 ‘안타곤’(Antagon, Ganirelix acetate, 국내서는 한국오가논의 ‘오가루트란주’, ganirelix acetate 0.25㎎) 등이다.
GnRH 길항제는 GnRH 작용제에 비해 생리 주기 후반에 투여하며, 투여 기간과 횟수를 줄일 수 있으며, 미성숙 난자의 조기배란(LH의 조기 급상승)을 방지하는 효과가 있다. 초음파로 난소를 관찰하면서 언제 투여를 시작할지 결정하게 된다. 조기배란은 최종 회수할 난자의 수를 줄일 수 있으므로 이를 막는 게 중요하다.
세트로타이드는 매일 아침 또는 저녁에 24시간 일정한 간격을 두고 하루 한번 주사한다. 소변 추출 또는 재조합 성선자극호르몬으로 난소를 자극하기 시작한 지 5~6일째에 세로토타이드를 투여해 배란 유도일 직전까지 계속 투여한다. 투여 후 8시간 만에 혈중 LH와 FSH의 상승을 억제하는 효과를 낸다.
인간난포자극호르몬(FSH)
FSH는 난소에서 난포를 자극해 성장시키는 역할을 함으로써 배란을 돕는 기초 토대를 만든다. 처음에는 순수한 FSH를 만들기 위해 폐경 여성의 소변에서 LH과 다양한 단백질을 제거(정제)한 뒤 75 IU를 포함하는 순수 FSH를 사용했고 지금도 쓰이고 있다. 대표적인 게 ‘Bravelle’(urofollitropin)이다. 지금은 이보다 생산비용이 저렴하고 고순도·고농도 양산이 가능한 유전자재조합 방식의 FSH가 보편화됐다.
유전자 재조합 방식 인간 FSH로는 독일 머크의 ‘고날에프펜주’(Gonal-F, 성분명 follitropin alpha), 오가논의 ‘퓨레곤펜주’(PUREGON) 및 ‘Follistim AQ’(이상 follitropin beta), 페링의 ‘레코벨프리필드펜’(REKOVELLE. follitropin delta), LG화학의 ‘폴리트롭프리필드시린지주’(FOLLITROPE, follitropin alpha에서 변형된 고날에프의 바이오시밀러로 간주되고 있음) 등이 있다.
폴리트로핀 알파(1세대), 베타(2세대)는 중국 헴스터 난소(CHO)에서 유전자 재조합 방식으로 생산된다. 폴리트로핀 델타(3세대)는 인간 PER.C6(유전조작을 가한 불멸화 1차적 인간 배아 망막세포)에서 유전자 재조합 기술로 생산된다.
이런 분류는 유전자 재조합 과정에서 각 폴리트로핀의 글리코실화 및 정제 과정이 다르기 때문이다. 폴리트로핀을 이루는 탄수화물 구조의 일부가 다르기 때문에 알파(pH 3.21~5.69)가 베타(pH 3.8~5.58)보다 약산 더 산성을 띠고, 더 많은 테트라 안테나 구조(tetra-antennary structure)를 갖고 있으며, 이로 인해 입체적 글리칸(glycan) 구조도 늘어나며 단백질 분자 당 순 양전하도 더 강한 것으로 알려져 있다. 이는 반감기를 다소 늘리는 효과가 있을 것으로 추정된다.
이와 관련, 폴리트로핀 베타가 환자에서 더 큰 에스트라디올 반응을 유도하는(에스트라디올 수치의 통계적으로 유의한 현저한 증가) 반면 폴리트로핀 알파는 더 높은 임상적 임신율(clinical pregnancy rate, CPR. 주기 당 32.8% 대 22.1%)을 올린다고 연구돼 있다. 이는 폴리트론 알파가 베타에 비해 반감기 연장돼 배란 유도 효과를 상승시키기 때문인 것으로 추정된다(일부 연구).
폴리트로핀 델타는 폴리트로핀 알파보다 더 산성을 띠고, 시알산 결합 비율이 높으며, 입체적으로 더 복잡하다고 알려져 있다.
여러 임상연구를 종합하면 델타는 알파보다 혈중 에스트로겐 수치가 낮았다. 난포자극지속시간은 델타가 더 길었다(12.97±2.38시간 대 13.96±2.26 시간). 난소과자극증후군(OHSS) 비율은 델타 그룹에서 알파 그룹보다 유의하게 낮았다(48.1% 대 58.6%). FSH에 대한 항체 생성은 델타가 알파보다 다소 높았으나 임신과 출산에는 큰 영향을 미치지 못했다. 배란 후 회수된 난자 수는 델타가 알파보다 적었으나(10.3 ± 6.2 대 12.5 ± 7.5), 임상적 임신율(35.4% 대 31.5%)과 실제 출산율(31.0% 대 25.5%)은 델타가 높았다.
독일에서 발표된 리얼월드데이터에 따르면 누적 출생률(Cumulative Live Birth Rate, LBR)은 폴리트로핀 델타 투여 여성군이 57.4%로, 폴리트로핀 알파/베타 투여군의 50.7%에 비해 유의미하게 개선됐다.
일본에서 진행된 폴리트로핀 델타와 폴리트로핀 알파 간의 비용-효과성 비교 분석에서, OHSS 발생률은 15.9% 대 27.0%로 델타가 우위를 보였다. 누적 임신율(Cumulative Pregnancy Rate, CPR)도 87.3% 대 76.2%로 델타가 더 높았다.
모든 폴리트로핀 제제의 반감기는 약 2시간이며, 대략 하루 만에 제거될 수 있다. 폴리트토핀 제제의 용량은 앰플 당 FSH 150~900 IU까지 다양하다. 외자사들은 과거의 75 IU 소용량 제품은 채산성을 이유로 국내에 도입되지 않고 있다. 다만 국산 제품(동아에스티 ‘고나도핀’)은 75 IU의 소용량이 있다.
폴리트로핀 델타(레코벨르)의 경우 혈청 항-뮐러 성호르몬(AMH, anti-Müllerian hormone, 항뮬러관호르몬) 농도와 체중에 기반해 투여량이 결정된다. AMH가 15 pmol(피코몰)/L 미만인 여성의 하루 투여량은 체중과 관계없이 12μg이다. 15 pmol 이상이면 체중 대비 투여량을 체감적으로 줄여서 투여한다.
참고로 AMH는 난자를 둘러싸고 있는 과립막세포(granulosa cell)에서 분비되는 호르몬으로 난소에 남아 있는 난자의 수를 평가하는 지표다. ‘난소 예비력’(ovarian reserve)이라고도 하며 이 수치가 높을수록 난자 보유량이 많다고 볼 수 있다. 다만 이는 양적 지표이지 질적 지표는 아니다. 난소의 질은 주로 여성의 나이와 관련 깊다.
AMH는 남성 태아발달 과정 중 뮬러관의 퇴화(테스토스테론 증가에 따른)를 촉진시키는 호르몬이다. 남성은 고환에서 AMH가 계속 분비되는데 사춘기까지 높게 유지되다가 이후 감소한다. 그러나 남성에서 AMH 수치가 낮은 게 남성 난임과 관련 있는 것은 아니다. 여성은 출생 시에는 미미하게 분비되지만 가임연령대 초기에는 최고조에 이르고 점차 감소해 폐경에 이르면 더 이상 검출되지 않는다.
황체형성호르몬(LH)
국내서 유일하게 시판되고 있는 LH 제제로는 독일 머크의 ‘루베리스주’(Luveris, 유전자재조합 루트로핀 알파, lutropin alfa(recombinant human luteinizing hormone), 75 IU)가 있다. 고순도 유전자재조합 제품이다.
황체형성호르몬은 배란을 자극하며 배란 후 난소에 남아 있는 난포가 황체로 변하여 황체호르몬(프로게스테론)을 분비하도록 촉진한다. LH 투여 후 16~32시간 뒤에 혈중농도가 최고조에 이르게 된다. LH 혈중농도 상승기에는 에스트로겐 수치가 감소하고 프로게스테론이 증가한다.
황체형성호르몬은 배란 주기(난포기-배란기-황체기)에 따라 혈중 농도가 변화한다. 난포기(배란 이전)에는 0.8~10.4 mIU/ml로 혈중 농도가 낮다가, 배란기에는 2.9 ~ 41.1 mIU로 급상승한다. 황체기(황체호르몬이 분비되고, 기초체온이 고온기에 해당하며, 내막이 두터워지고 임신을 준비하는 기간)에 접어들면 LH 농도는 0.5~7.6 mIU로 다시 낮아진다.
루베리스는 혈중 LH 농도가 1.21 IU미만이어야만 건강보험 급여가 됐는데 2024년 4월에 이 기준이 삭제돼 보다 많은 난임 환자가 혜택을 보게 됐다. 중증의 황체형성호르몬(LH)와 난포자극호르몬(FSH) 결핍 여성에서, 단독으로 사용하지 않고 FSH 제제와 병용하도록 돼 있다.
HMG(Human Menoausal Gonadotropine, menotrophin)
HMG(인간폐경기성선자극호르몬)는 폐경기 여성의 소변에서 추출한 것으로 FSH 및 LH가 일정한 비율(즉 1대1, 또는 2대1)로 함유하고 있다. 난소에 작용해, 즉 난소 과자극을 유발해 난포를 발달시킨다.
35세 이상의 고위험 임신(생물학적으로 높은 나이) 여성이나 난소 저반응군 여성은 난소 기능을 극대화하기 위해 FSH와 LH를 모두 투여해야 한다는 게 최근 주류 학설이다.
요 기반 uHMG는 폐경후 여성의 소변으로부터 채취한 FSH 및 LH를 1대1(IU 기준)로 함유하고 있다. 폐경 또는 폐경 주변기(45세 이상)에 이르면 여성의 난자 수와 에스트로겐은 줄어들지만 생식 본능으로 배란하려는 성향이 강해지고, 에스트로겐 감소에 대한 피드백 반응으로 FSH 수치가 증가하는 경향을 보이기 때문에 이를 의약품 원료로 활용하는 것이다. 폐경 주변기(대략 마지막 월경 3년 전후)에는 FSH 수치가 지속적으로 증가하다가 이후 하향세를 보인다.
자연 상태의 폐경 여성 소변에서는 FSH와 LH가 거의 동일한 비율로 존재하며 소량의 HCG와 비(非) 생식선자극단백질 등이 함유돼 있다. 이들 혼합물의 별칭이 menotrophin이다.
독일 머크의 ‘퍼고날주75IU’(Pergonal, 국내서 단종)은 1 앰플에 75 IU의 메노트로핀이 들어 있다.
LG화학의 ‘아이브이에프엠에이치피 멀티도즈주 600IU’(IVF-M-HP-600) 및 ‘아이브이에프엠에이치피 멀티도즈주 75IU’(IVF-M-HP-75)는 폐경 여성의 소변에서 고순도 정체 추출한 메노트로핀이 각각 600 IU, 75 IU씩 들어 있다. FSH 대 LH 비율이 1대 1이며, 즉 FSH 및 LH가 각각 600, 75 IU씩 1대 1 비율로 함유돼 있으며 다른 불순물은 최소화돼 있다. 페링의 ‘메노푸어 멀디도즈’(MENOPUR MULTIDOSE) 역시 FSH 및 LH가 각각 600, 75 IU씩 1대 1 비율로 함유된 폐경 여성 소변 고순도 추출 제품이다.
이보다 진보한 독일 머크의 ‘퍼고베리스주’(PERGOVERIS, 성분명 follitropin alfa(FSH)/lutropin alfa(LH))는 모두 유전자 재조합 방식이며 각각 2대1 배합이다. 150/75, 300/150, 450/225, 900/450 IU 용량의 4가지 제품을 갖추고 있다.
유전자재조합 방식의 r-hFSH와 r-hLH 병용요법(퍼고베리스)은 35~40세 여성에게서 더 많은 난모세포를 회수하고 임신율을 유의하게 높인다는 게 페링의 설명이다. r-hFSH와 r-hLH 병용요법은 각각을 고순도로 일정한 비율로 함유하고 있기 때문에 약간의 hCG 및 기타 단백질을 포함한 요 기반 HP-hMG(고순도 메노트로핀) 단독요법보다 난포 성장 조절이 용이하고 더 나은 임신 성공률을 가져다준다는 것이다.
페링의 임상 연구에 따르면, r-hFSH/r-hLH 병용요법군이 HP-hMG 단독요법군 대비 더 높은 임상적 임신율과 더 짧은 임신까지의 도달 시간을 보였다. 특히 기초 난소 예비력 지표 중 하나인 난소 내 난포수(Antral follicle count, AFC: 25~34세에는 10~13, 35~45세에는 8~10이 정상치)가 4 미만인 여성에서는 병용요법군이 단독요법군보다 임상적 임신율(10.2% vs. 1.5%, p<0.01)과 착상률(13.0% vs. 2.8%, p<0.02) 모두 유의미하게 높았다. </p>
퍼고베리스는 중증의 난포자극호르몬(FSH)과 황체형성호르몬(LH) 결핍 여성에서 난포 발달의 자극 용도로 허가받았다.
퍼고베리스는 혈중 LH 농도가 1.21 IU미만이어야만 건강보험 급여가 됐는데 2024년 4월에 이 기준이 삭제돼 보다 많은 난임 환자가 혜택을 보게 됐다. 현재 FSH 150IU / LH 75 IU인 제품만 하루 2 바이알까지 건강보험을 인정받는다.
FSH와 LH가 배합된 복합제 주사제는 각각 따로 맞는 불편이 없기 때문에 매일 맞아야 하는 특성상 환자에게 부담을 덜어준다.
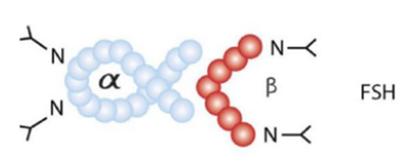
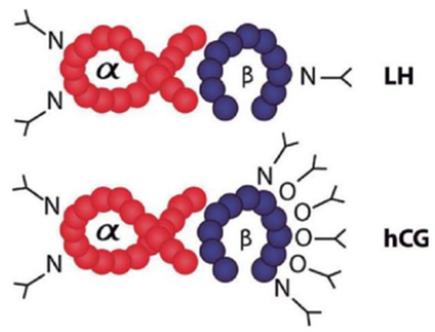
LH, HCG, FSH는 모두 동일한 알파 서브유닛을 가지고 있다. LH와 HCG의 베타 서브유닛은 유사한 반면 FSH는 많이 다르다. 세 호르몬의 베타 서브유닛은 다양한 N-연결 글리코실화(글리코실기를 단백질의 N(질소) 분자에 결합시키는 것)를 통해 차별성을 보인다. 글리코실기는 고리형 단당류에서 헤미아세탈(OR-C-OH)의 하이드록실기(OH, 일종의 알코올기)를 떼어내 다른 유기물 또는 무기물과 결합할 수 있는 형태의 치환체 구조를 말한다.
HCG(Human Chorionic Gonadotropine, hCG)
HCG(인간융모막성선자극호르몬, 인간태반성선자극호르몬)는 본래 임신 중 태반의 양막에서 주로 생성되며 황체를 자극해 프로게스테론을 생성, 임신을 유지한다. 임신한 여성의 소변이나 태반에서 추출해 제품화한다. 불임 치료에서는 배란을 유도하고 난자의 최종 방출 과정에 기여한다. 근육주사 후 36~48시간 뒤에 배란이 유도된다고 알려져 있다.
HCG는 뇌하수체에서 생성되는 LH와 유사한 구조를 갖고 LH의 기능을 모방한다. HMG 치료제는 FSH 및 LH를 1대1 또는 2대1로 함유한 반면 HCG는 LH가 FSH보다 높은 비율로 함유돼 있다.
Novarel, Pregnyl, Profasi, Ovidrel 등의 상품명이 있으며 모두 동일 성분이다. Novarel, Pregnyl, Profasi 등은 소변에서 추출한 요 기반 uHCG이며, Ovidrel은 유전자재조합 방식으로 생산된 재조합 rHCG이다. 임상 효과 면에서 큰 차이는 없는 것으로 알려져 있다. 무배란성 불임증, 보조생식술에서 배란촉진, 황체기능 부전, 습관성 유산, 절박성 유산 등의 적응증을 갖고 있다.
적정량의 메노트로핀(HMG) 또는 인간난포자극호르몬(FSH)을 투여한 다음 의사의 지시에 따라 HCG로서 최대 1만 IU(바이알 개당 1500 IU 함유)를 근육주사한다. 난소과자극증후군의 위험을 줄이기 위해 HCG 용량을 5000 IU로 줄여 투여할 수도 있다. 프로게스테론 생성을 자극하기 위해 난자 회수(배란 후 난자 채집) 후 2500 IU를 보통 3일마다 여러 차례 투여하는 경우도 종종 있다.