사노피와 리제네론파마슈티컬스는 아토피피부염 치료제 ‘듀피젠트프리필드주’(Dupixent, 성분명 두필루맙, dupilumab)가 미국 식품의약국(FDA)으로부터 성인 수포성 유사천포창((bullous pemphigoid, BP) 치료 적응증을 추가 승인받았다고 20일(현지시각) 발표했다.
이번 승인은 중등도~중증의 성인 BP 환자 106명을 대상으로 듀피젠트의 유효성 및 안전성을 평가하는 2/3상 ‘LIBERTY-BP ADEPT’ 연구(NCT04206553) 데이터를 기반으로 이뤄졌다.
임상시험에 참여한 환자들은 표준치료인 경구 코르티코스테로이드(OCS)에 추가로 듀피젠트 또는 위약을 투여받았다. 치료 기간 동안 모든 환자는 질병 활성도가 조절되는 경우 프로토콜에 정의된 경구 코르티코스테로이드 감량 요법을 받았다.
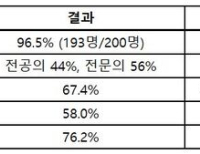
치료 36주 결과에 따르면 1차 평가지표인 지속적인 질병 관해를 경험한 환자 비율은 듀피젠트 투여군이 18.3%로 나타났고 이에 비해 위약군은 6.1%였다.
임상적으로 의미 있는 수준의 가려움증 감소를 달성한 환자 비율은 듀피젠트 투여군이 38.3%, 위약군이 10.5%로 집계됐다. 경구 코르티코스테로이드 누적 용량 중앙값은 듀피젠트 투여군이 2.8g, 위약군이 4.1g이었다.
이 고령 환자 중 듀피젠트 투여군에서 더 자주 관찰된 가장 흔한 이상반응은 관절통, 결막염, 시야 흐림, 헤르페스 바이러스 감염, 각막염이었다. 듀피젠트를 투여받은 환자 1명에서는 급성 전신발진농포증이 보고됐는데 위약군에서는 보고되지 않았다. 
듀피젠트는 인터루킨-4(IL-4) 및 인터루킨-13(IL-13) 경로의 신호 전달을 억제하는 단일클론항체로 아토피피부염, 천식, 비용종을 동반한 만성 비부비동염, 결절성 가려움 발진, 만성 폐쇄성 폐질환 치료제로 승인된 바 있다. 미국에서는 호산구성 식도염, 만성 특발성 두드러기에 대한 치료제로도 승인됐다. 이번 BP 추가로 모두 8번째 적응증을 획득하게 됐다.
수포성 유사천포창은 주로 고령층 환자에서 나타난다. 극심한 소양증과 고통을 수반하는 수포(水泡), 병변, 피부발적 등이 특징적이다. 만성적으로 나타나고 2형 염증을 동반한 재발이 잦다. .
수포와 발진이 전신의 대부분에 걸쳐 나타나고 피부 출혈, 피부층 와해(break down)로 인해 감염증에 걸리거나 일상생활 기능에 심각한 지장을 받는다. 현재 사용할 수 있는 치료제가 제한적이고 면억억제제를 쓰지만 경제적, 사회적 질병 부담이 크다.
사노피의 알리사 존슨(Alyssa Johnsen) 글로벌 치료제 부문 및 면역학‧종양학 개발 담당대표는 “지금까지 고령층 수포성 유사천포창 환자들을 치료하는 일이 대단히 도전적인 과제였다”며 “수포성 유사천포창에 관여하는 두 가지 중심적인 기저 2형 염증 촉발요인들에 대응할 수 있도록 해 주는 듀피젠트는 지속적인 관해와 소양증 감소 효과를 환자들에게 제공하는 최초의 표적치료제가 될 것”이라고 말했다.
듀피젠트는 FDA ‘우선심사’ 대상으로 지정돼 당초 20일까지 승인 여부가 결정될 예정이었다. 동일 적응증 추가 승인 심사가 유럽연합(EU), 일본, 중국 등에서 진행 중이다.